4
.
5
-
Infections bactériennes néonatales
4
.
5
.
1
-
Définitions
La prévalence de l’infection bactérienne néonatale demeure élevée mais significativement réduite depuis les mesures de prise en charge périnatale et notamment depuis la généralisation de l’antibioprophylaxie des infections néonatales précoces à streptocoque B.
On distingue les infections bactériennes primitives, qui regroupent les infections maternofœtales (IMF, les plus fréquentes) et les infections néonatales tardives primitives, des infections secondaires (nosocomiales), survenant en cours d’hospitalisation.
Seules les infections bactériennes primitives seront étudiées dans ce chapitre. Les infections virales et parasitaires ont été traitées dans les paragraphes précédents.
Les IMF, de transmission anté- ou pernatale, surviennent le plus souvent dans les 72 premières heures de vie. Les modes de contamination sont le plus souvent la voie transmembranaire (chorioamniotite) avec ou sans rupture des membranes et la voie ascendante (depuis la filière génitale) lors de l’accouchement, plus rarement la voie hématogène transplacentaire.
Les bactéries les plus fréquemment en cause sont le streptocoque du groupe B (SGB), puis Escherichia coli. Pour ce dernier, le sérotype capsulaire K1 est le plus redoutable, puisqu’il est responsable de méningites néonatales et de septicémies. Les autres streptocoques (notamment entérocoque), bacilles Gram négatifs et anaérobies sont plus rares. Listeria monocytogenes est devenue très rare.
Les deux germes les plus fréquents des IMF sont le streptocoque du groupe B et E. coli.
4
.
5
.
2
-
Diagnostic d’IMF
Enquête clinique
Les données d’anamnèse concernant la grossesse ou l’accouchement sont essentielles pour suspecter une infection. Les facteurs de risque (critères) anamnestiques d’IMF sont actuellement classés en majeurs et mineurs selon les recommandations Anaes de 2002 qui devraient être prochainement réactualisées (tableau 1.9).
Chez un nouveau-né asymptomatique, la présence d’un de ces critères (ou plus) nécessite une surveillance clinique rapprochée pendant les 24 premières heures de vie, des prélèvements bactériologiques voire un bilan biologique sanguin (voir § 3 Prise en charge en cas de suspicion d’IMF).
Il n’existe pas de signe clinique spécifique. Les symptômes possibles sont nombreux, mais rarement tous réunis. Chacun d’entre eux doit attirer l’attention.
Toute anomalie clinique doit faire suspecter une IMF :
- troubles de la régulation thermique :
- fièvre (≥ 38 °C, rare en pratique), hypothermie (< 35 °C),
- modification de la température de régulation (si enfant en incubateur) ;
- signes hémodynamiques :
- teint gris, pâleur, marbrures,
- tachycardie, TRC ≥ 3 s, hypotension artérielle ;
- signes respiratoires :
- geignements, signes de lutte respiratoire inexpliqués,
- tachypnée, apnées et accès de cyanose ;
- signes neurologiques :
- hyporéactivité, somnolence, troubles de la conscience, irritabilité,
- troubles du tonus, convulsions,
- bombement de la fontanelle ;
- autres :
- difficultés alimentaires, mauvaise prise de poids,
- hépatomégalie, splénomégalie, ballonnement abdominal,
- purpura, éruption cutanée de tous types, ictère (précoce, prolongé), omphalite,
- diminution de la mobilité spontanée ou douleur à la mobilisation d’un membre.
Enquête paraclinique
La bactériologie permet de confirmer le diagnostic et de préciser le germe en cause.
Les autres examens complémentaires servent à étayer la probabilité d’une infection.
Examens à pratiquer chez un nouveau-né suspect d’IMF :
- hémoculture = examen de référence (sensibilité médiocre ≈ 20 %) :
- systématique avant toute antibiothérapie,
- culture ≥ 48 h + sérotypage SGB et E. coli ;
- bilan inflammatoire :
- NFS et CRP (ayant habituellement peu d’intérêt avant 12 heures de vie),
- procalcitonine au sang du cordon (en cours de validation) ;
- ponction lombaire (chez un enfant stable, sans retarder l’antibiothérapie) :
- en cas de signes généraux ou de sepsis, de signes neurologiques,
- en cas de positivité des hémocultures ;
Les frottis et culture placentaires ne sont plus utilisés en routine.
L’ECBU est indispensable dans le seul cadre des infections néonatales tardives.
Les prélèvements périphériques (gastriques et orificiels) ne sont plus systématiquement pratiqués à la naissance par les services de néonatalogie. Les recommandations Anaes de 2002 qui les citent dans l’enquête paraclinique (fig. 1.12) connaîtront sur ce sujet une nouvelle rédaction prochaine.
Le dosage de la procalcitonine au sang du cordon semble être un marqueur à la fois sensible et spécifique de l’infection maternofœtale. Ces résultats demandent à être confirmés par des études multicentriques en cours de validation.
En l’absence d’antibiothérapie maternelle, la négativité des examens paracliniques constitue un élément important pour éliminer une IMF.
Lorsque le nouveau-né est cliniquement et/ou biologiquement suspect d’infection, une bactérie isolée dans le liquide gastrique rend probable le diagnostic d’infection à ce germe, en particulier si cette bactérie est reconnue comme à risque d’IMF.
Une antibiothérapie systématique serait inutile et à risque chez des enfants indemnes de suspicion clinique diagnostique.
Principaux facteurs de risque d’IMF : fièvre maternelle, RPDE > 12 h, chorioamniotite, prématurité.
Tout nouveau-né symptomatique est suspect d’infection jusqu’à preuve du contraire. Dans tous les cas, l’examen clinique est primordial pour porter le diagnostic d’infection néonatale dès la naissance en maternité ou au-delà.
Examen paraclinique essentiel : l’hémoculture.
4
.
5
.
3
-
Prise en charge en cas de suspicion d’IMF
Nouveau-né symptomatique
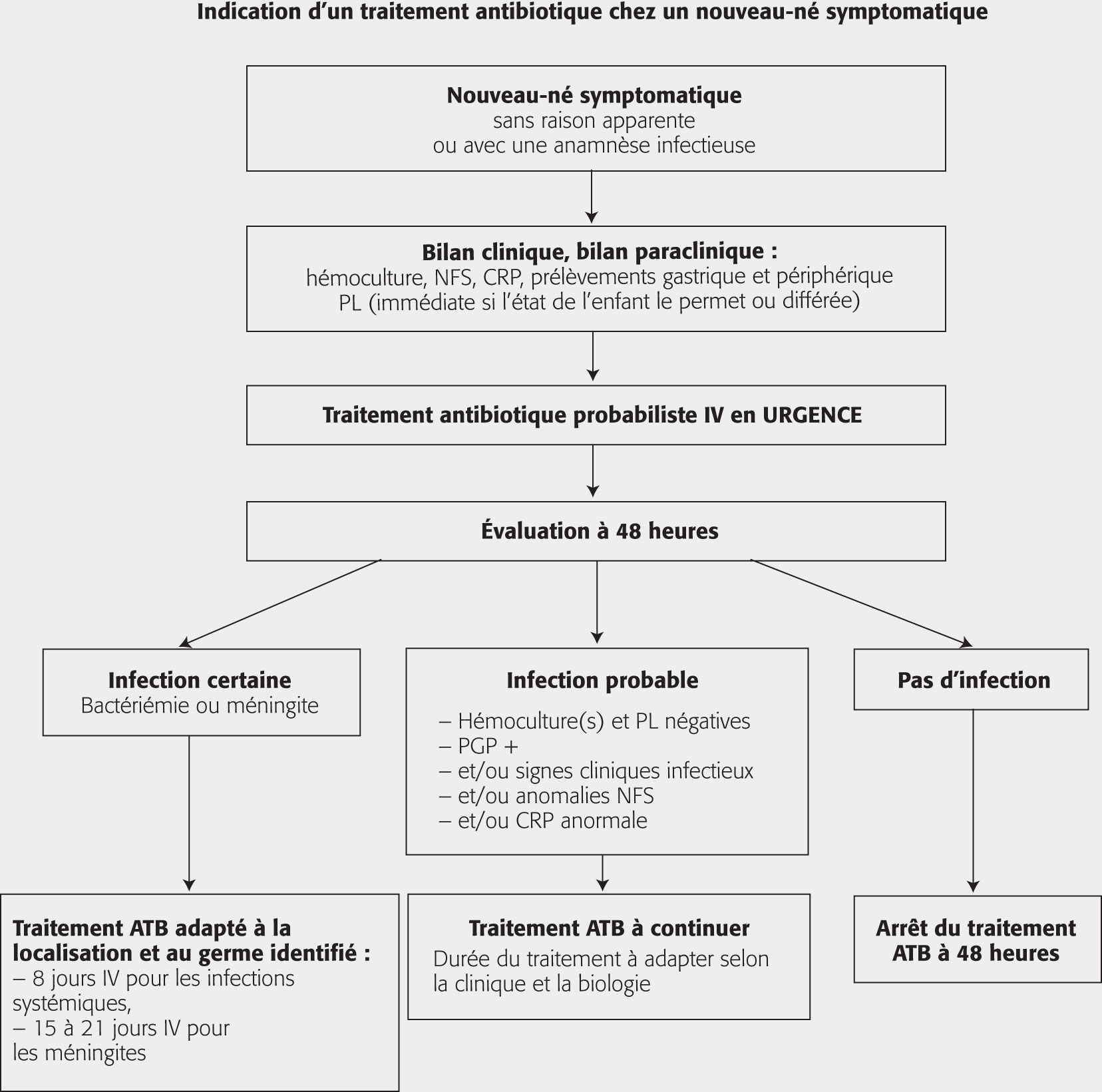
Quand l’enfant est symptomatique, une antibiothérapie probabiliste par voie IV doit être administrée en urgence après bilan clinique, biologique et bactériologique (fig. 1.12).
Les antibiotiques à spectres les plus larges doivent être privilégiés selon les contextes de l’épidémiologie locale (proportion E. coli, SGB).
Une bithérapie par bêtalactamines (amoxicilline ou céfotaxime) + gentamycine IV est le plus souvent recommandée.
Après 48 heures de traitement, une réévaluation est faite, fondée sur l’état clinique de l’enfant et les résultats des examens paracliniques, en particulier bactériologiques. Le traitement sera alors interrompu, poursuivi ou adapté.
Nouveau-né asymptomatique
Si le nouveau-né est asymptomatique mais a des critères anamnestiques de suspicion d’IMF, la décision de traitement est fonction des critères présents (majeurs/mineurs) et de l’évolutivité d’éventuels marqueurs paracliniques. Une chorioamniotite maternelle et une IMF chez le jumeau sont deux indications formelles d’antibiothérapie immédiate.
Dans les autres situations, le bilan biologique sanguin et la décision d’antibiothérapie sont différés à H12. L’association de facteurs de risque et d’un syndrome inflammatoire est habituellement l’indication à une antibiothérapie probabiliste, qui fait l’objet d’une réévaluation après 48 h de traitement (voir supra).
L’évolution des pratiques va vers une réduction des politiques d’antibiothérapies excessives chez les nouveau-nés asymptomatiques cliniquement, régulièrement surveillés.
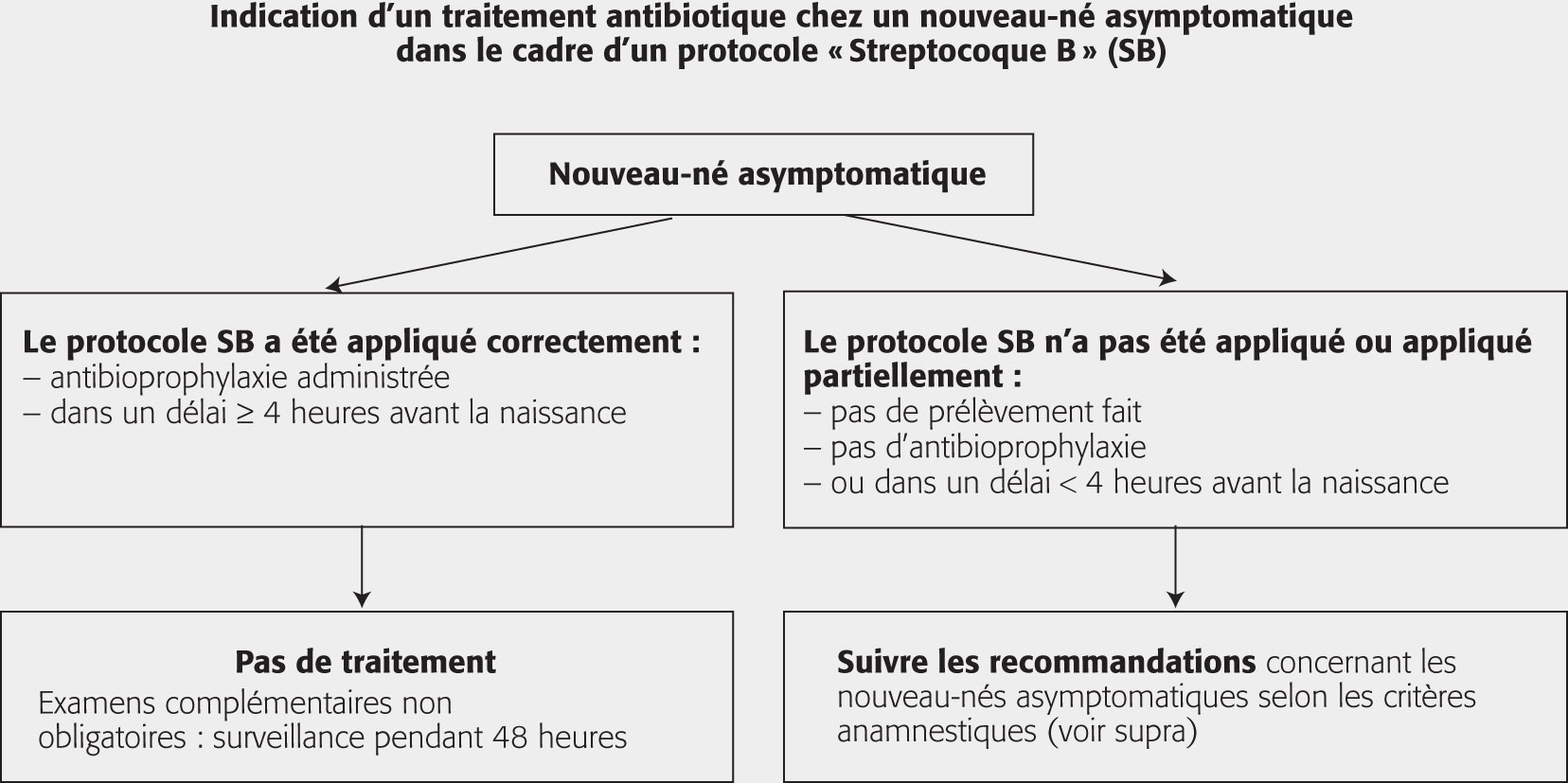
La prise en charge des suspicions d’IMF à SGB constitue un cas particulier.
Le dépistage systématique du portage vaginal de SGB (prévalence ≈ 10 %) est recommandé à partir du terme de 34 SA. Une antibioprophylaxie per-partum (chez la mère) par pénicilline G ou amoxicilline IV est recommandée en cas de dépistage vaginal positif du SGB, d’antécédent d’infection à SGB, de bactériurie à SGB en cours de grossesse, de rupture prolongée des membranes (> 12 h), et de fièvre maternelle (> 38 °C) pendant le travail.
En fonction du respect ou non de ces mesures de prévention des IMF à SGB, la prise en charge des nouveau-nés asymptomatiques fait l’objet d’une recommandation de l’Anaes (fig. 1.13).
L’infection bactérienne néonatale doit être suspectée sur des critères cliniques, confortée par certaines données biologiques et affirmée par les examens bactériologiques les plus utiles (hémoculture, LCR, ECBU).
Nouveau-né symptomatique, chorioamniotite ou jumeau atteint d’IMF : biantibiothérapie probabiliste IV et réévaluation à H48.
13/18