4
.
2
.
3
-
Complications
Généralités
Le nouveau-né prématuré est caractérisé par l’immaturité de toutes ses fonctions physiologiques, à l’origine des pathologies spécifiques de la prématurité (tableau 1.7).
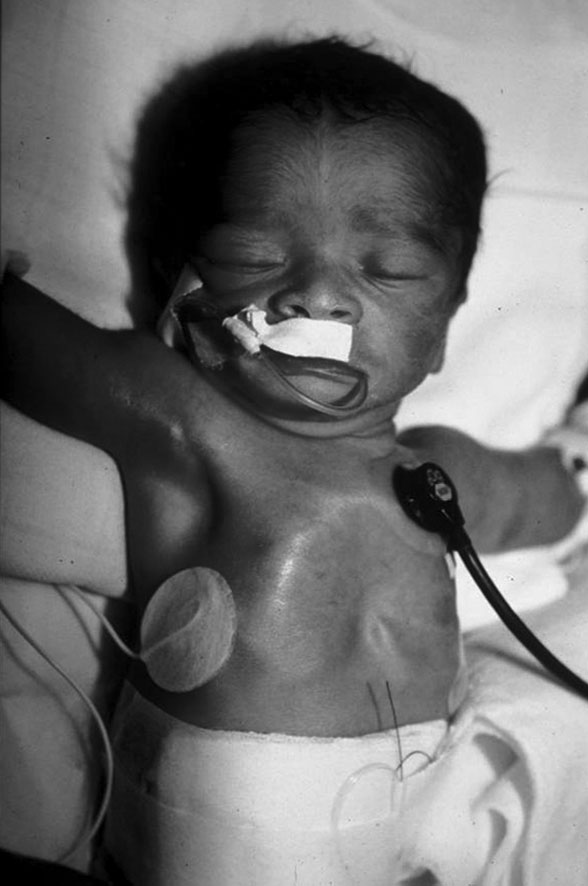
Maladie des membranes hyalines (MMH)
La MMH est secondaire à un déficit en surfactant, conduisant à un collapsus alvéolaire.
Elle est d’autant plus fréquente que l’enfant est plus immature (80 % avant 28 SA).
Elle réalise un tableau clinique de détresse respiratoire aiguë (fig. 1.9), sans intervalle libre par rapport à la naissance, avec geignement expiratoire.
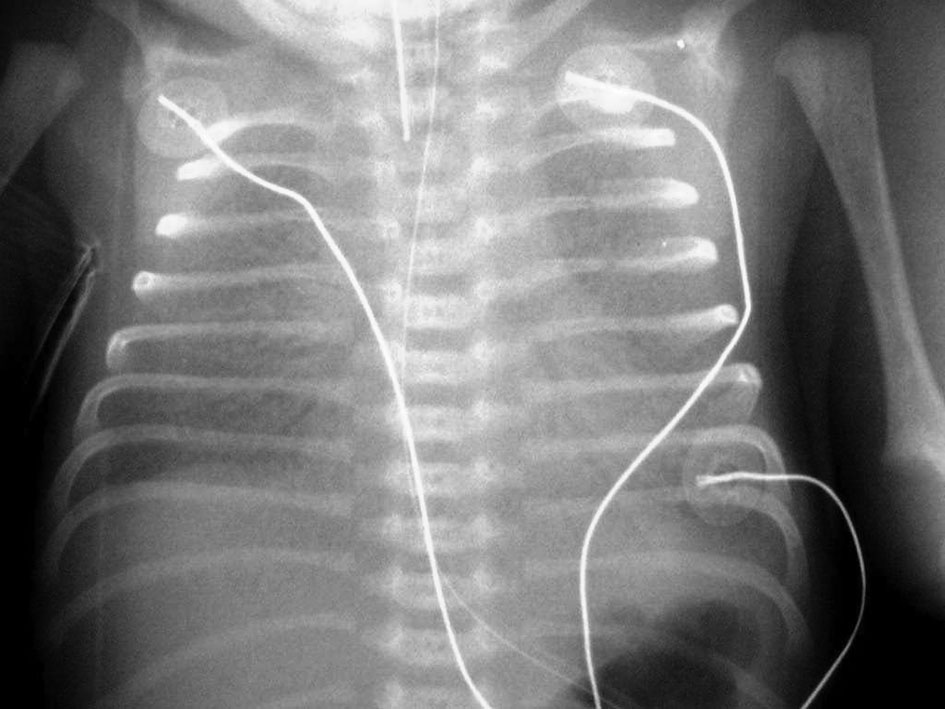
La radiographie thoracique (fig. 1.10) montre un petit volume pulmonaire et un syndrome alvéolaire bilatéral, avec bronchogramme aérien.
Son traitement associe une instillation trachéale de surfactant exogène à une ventilation mécanique avec pression expiratoire positive (PEP) par voie nasale (ventilation non invasive) ou endotrachéale.
Sa prévention repose sur une corticothérapie prénatale en cas de risque de prématurité avant le terme de 34 SA.
Apnées et bradycardies
Les apnées sont secondaires à une immaturité de la commande respiratoire du SNC.
Elles sont prévenues par l’administration quotidienne de caféine, systématique avant 32 SA.
Persistance du canal artériel
Il s’agit de l’absence de fermeture fonctionnelle du canal artériel.
Le canal artériel est situé entre la branche gauche de l’artère pulmonaire et l’aorte. Il se ferme normalement par vasoconstriction dans les premiers jours de vie.
Elle est d’autant plus fréquente que l’âge gestationnel est faible.
Le diagnostic est évoqué au décours de la phase aiguë d’une MMH devant des signes cliniques d’aggravation respiratoire, ou encore devant l’existence d’un souffle systolique continu ou d’une hyperpulsatilité des pouls fémoraux.
L’écho-Doppler cardiaque confirme le diagnostic et évalue le retentissement hémodynamique.
Dysplasie bronchopulmonaire
Elle résulte d’une altération de la croissance alvéolaire liée à l’immaturité pulmonaire et aggravée par des facteurs comme la ventilation assistée et l’hyperoxie.
Elle est d’autant plus fréquente que l’enfant est plus immature.
Elle est définie par la persistance d’une oxygénodépendance (ou de la nécessité d’un soutien ventilatoire) à 36 SA d’âge corrigé.
Conséquences de l’immaturité digestive
L’immaturité de la coordination succion-déglutition-respiration rend nécessaire l’alimentation par sonde gastrique jusqu’aux alentours de 35 SA d’âge corrigé.
L’immaturité des fonctions digestives et du péristaltisme rend nécessaire la progression prudente des rations alimentaires et une nutrition parentérale de complément prolongée chez les enfants les plus immatures.
Entérocolite ulcéronécrosante (ECUN)
L’ECUN est une pathologie d’origine multifactorielle potentiellement gravissime, caractérisée par une nécrose ischémo-hémorragique plus ou moins étendue des parois du côlon et/ou du grêle, pouvant se compliquer de perforation.
Elle atteint 1 à 5 % des prématurés.
Elle associe un tableau occlusif et septique sévère, des rectorragies et une pneumatose des anses intestinales à l’ASP (présence d’air dans les parois intestinales).
Il s’agit d’une urgence digestive médico-chirurgicale.
Le traitement de première intention comprend une antibiothérapie associée au repos digestif avec aspiration gastrique et alimentation parentérale exclusive prolongée. Une réanimation lourde (notamment ventilation mécanique, expansion volémique, éventuellement inotropes) peut être nécessaire.
Une prise en charge chirurgicale (stomie de dérivation) est requise dans les formes compliquées et/ou sévères.
Leucomalacie périventriculaire
Elle est définie par des lésions de nécrose de la substance blanche périventriculaire, qui évoluent vers une gliose et/ou des cavitations.
Ses principaux facteurs de risques (en dehors de la prématurité) sont la rupture prématurée des membranes (RPM) et la chorioamniotite.
Elle atteint 5 à 10 % des grands prématurés.
Elle a peu de traduction clinique en période néonatale.
Le diagnostic est porté par l’échographie cérébrale transfontanellaire qui montre des hyperéchogénicités de la substance blanche périventriculaire évoluant vers des cavités. L’IRM cérébrale permet de préciser l’étendue des lésions.
La leucomalacie périventriculaire représente un facteur de risque majeur de séquelles neurodéveloppementales à long terme (voir infra).
Devenir à long terme
Le risque de décès concerne surtout les extrêmes prématurés. Entre 24 et 27 SA, la mortalité est de l’ordre de 30 % ; elle est inférieure à 10 % entre 28 et 31 SA.
Le risque de séquelles est d’autant plus important que l’enfant est prématuré. Le risque de séquelles graves et de handicap concerne essentiellement les enfants nés avant 32 SA. Ainsi, la majorité des prématurés, qui naît après 32 SA, a une évolution favorable.
Les séquelles de la prématurité sont de plusieurs types :
- séquelles motrices (diplégie spastique le plus souvent) ;
- troubles neuromoteurs mineurs (troubles de coordination, de la motricité fine) ;
- séquelles cognitives et troubles des apprentissages ;
- troubles du comportement ;
- séquelles neurosensorielles : surdité, troubles visuels sévères, troubles de la réfraction et strabisme ;
- séquelles respiratoires, essentiellement pendant les 2 premières années de vie ;
- troubles de la croissance staturo-pondérale.
Le nouveau-né prématuré est caractérisé par l’immaturité de toutes ses fonctions physiologiques, à l’origine de pathologies spécifiques, notamment respiratoires (maladie des membranes hyalines, dysplasie bronchopulmonaire) et neurosensorielles (hémorragies intraventriculaires, leucomalacie périventriculaire et rétinopathie du prématuré).
La corticothérapie anténatale indiquée en cas de MAP jusqu’à 34 SA est un facteur majeur de prévention des complications de la prématurité (MMH).
8/18