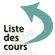- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Introduction
- 2 - Généralités biologiques
- 3 - Physiopathologie
- 4 - Clinique
- 5 - Diagnostic
- 6 - Examens complémentaires non biologiques
- 7 - Traitement
- 8 - Prophylaxie
- Points essentiels
-
Version PDF

-
Contenu
- Evaluations
- Annexes
5 . 2 - Diagnostic direct (phase d’état)
5 . 2 . 1 - Mise en évidence des œufs
La mise en évidence des œufs apporte la preuve indiscutable de la parasitose. Elle est en principe toujours possible à la phase d’état de l’affection, lorsque le ver sera arrivé à maturité soit 2 à 3 mois après l’infestation par les furcocercaires. Cependant, sa réalisation se heurte parfois à des difficultés techniques et dans le cas d’infestation modérée, elle peut être malaisée. Si la présence d'oeufs dans un produit biologique (urines, selle, biopsie) affirme le diagnostic de bilharziose, leur absence n'exclut pas l'existence d'une bilharziose évolutive. D'une part, la ponte ne débute qu'après plusieurs semaines, d'autre part, les oeufs ne sont retrouvés que dans 60 à 70% des cas avec des variations individuelles importantes. Dans ce cas, la clinique, le contexte épidémiologique associé au diagnostic sérologique prennent toute leur valeur.
5 . 2 . 1 . 1 - Recherche des œufs dans les urines
Il s’agit uniquement d’œufs de S. haematobium. Le meilleur examen consiste à examiner le culot de sédimentation des urines de 24 h après avoir éliminé les substances chimiques gênant la lecture (les phosphates et le sang essentiellement). En cas d’impossibilité de recueillir les urines de 24 heures, les œufs peuvent être recherchés dans les dernières gouttes d’urines et de préférence sur miction complète matinale, si possible, après un effort physique prémictionnel (marche à pied, montée d’un escalier, gymnastique pelvienne, sautillement…). Ces urines seront décantées pendant 24 heures et après avoir rejeté le surnageant, elles seront centrifugées à 1 500 tours/ minute pendant 3 à 4 mn. Le culot de centrifugation sera examiné en totalité.
La technique de filtration sur membrane est une méthode sensible et fidèle et permet une évaluation quantitative (nombre d’œufs par litre d’urine).
Dans la technique de filtration, on aspire les urines à travers un papier filtre placé sur une surface poreuse et généralement retenu par un anneau de métal qui canalise le liquide. Le papier filtre est alors traité au formol ou légèrement chauffé de manière à tuer les œufs, après quoi on le mouille à l’aide d’une solution aqueuse récemment préparée de ninhydrine et on le chauffe à nouveau légèrement pour le faire sécher. Sous l’action du colorant, les embryons prennent une teinte pourpre très nette, sans que la forme de l’œuf s’en trouve modifiée. Pour des études épidémiologiques sur le terrain, l’O.M.S. recommande l’emploi de filtre réutilisable (Nytrel®) dont le prix de revient est peu élevé. Ce sont des filtres en tissu monofilament polyamide qui donnent des résultats aussi précis que le filtre à membrane polycarbonate (Nucleopore®) dans la technique de filtration avec seringue pour le diagnostic et l’évaluation quantitative des œufs de S. haematobium dans l’urine.
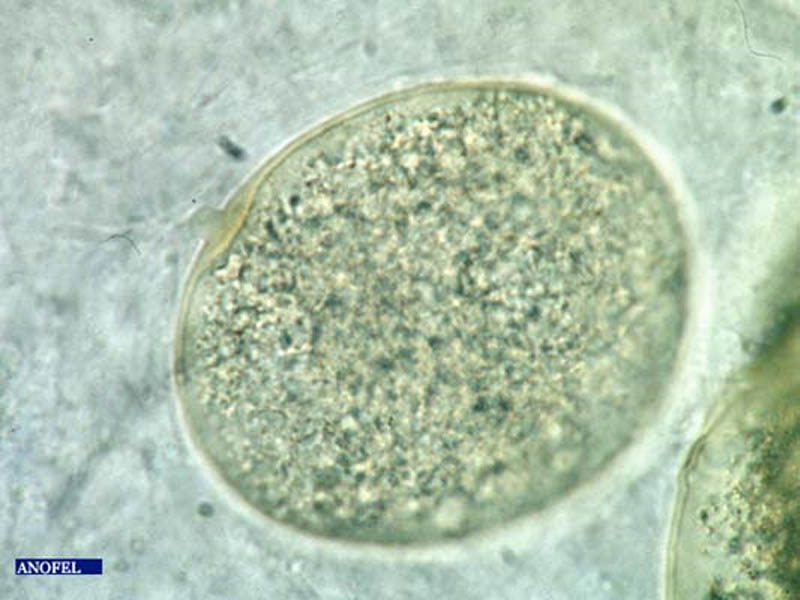
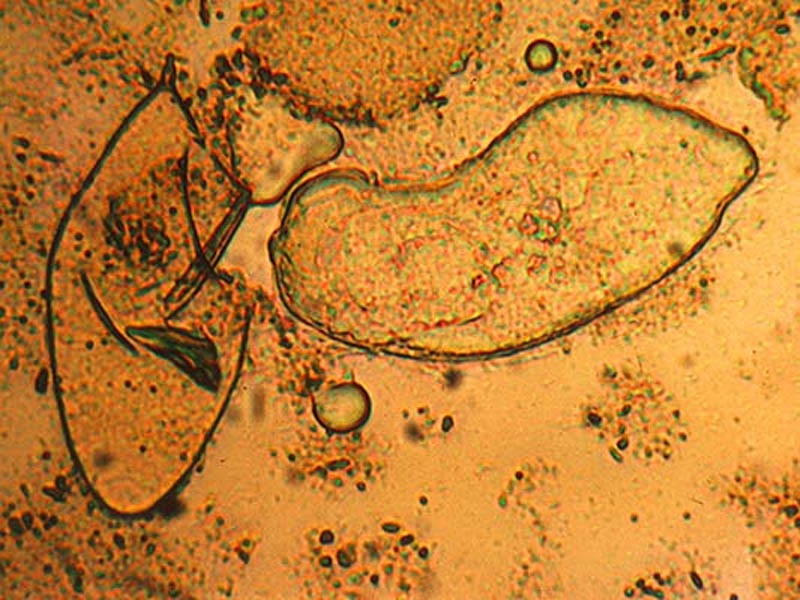
Les œufs de S. haematobium sont grands, mesurant en moyenne 150 µm sur 60 µm.
Ils sont de forme ovalaire, réguliers, normalement sans rétrécissement au pôle opposé à l’éperon. Celui-ci est terminal, apical. La coque est simple, épaisse, plus ou moins incolore dans les urines, et à contour jaune clair dans les selles (noirâtre si œuf mort). Le miracidium est bien visible dans les œufs vivants grâce aux cils vibratiles.
Figure 16 : Œuf de Schistosoma haematobium
5 . 2 . 1 . 2 - Recherche des œufs dans les selles
Le rectum étant un carrefour pour les 6 espèces de schistosomes, les œufs de S. mansoni, S. japonicum, S. mekongi, S. intercalatum, S. guineensis et parfois S. haematobium peuvent être rencontrés au cours d’un examen de selles.
L’examen direct et les techniques de concentration sont réalisés en utilisant, de préférence, la partie superficielle (externe) de la matière fécale plus riche en éléments parasitaires. Diverses techniques peuvent être utilisées : de la sédimentation en eau glycérinée à 0,5 %, technique simple de « terrain », aux méthodes de flottation (Janeckso-Urbanyi, Faust,…), ou aux méthodes diphasiques (merthiolate-iode-formol, Bailenger, …). Pour les techniques de flottation, recueillir après centrifugation, la partie superficielle avec un agitateur, pour les techniques diphasiques, chercher les œufs dans le culot, dans les deux cas, porter le prélèvement sur une lame et examiner.
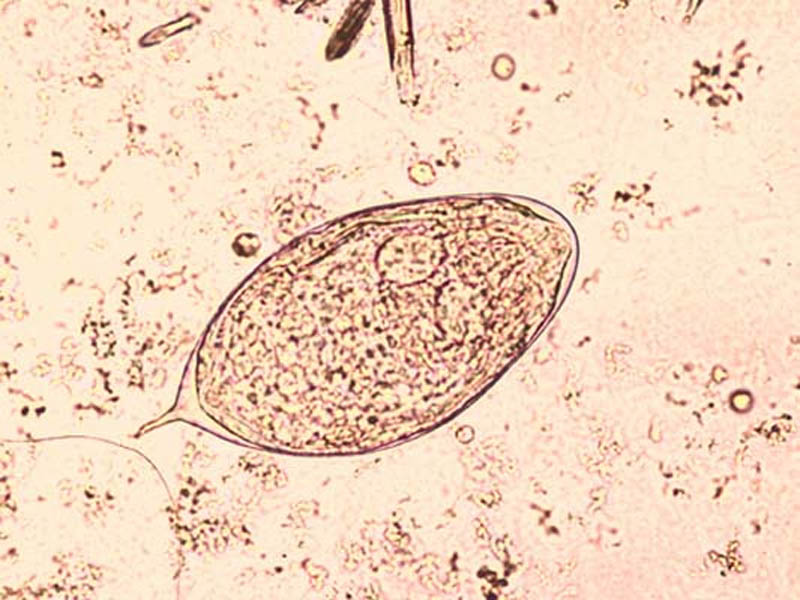
Les œufs de S. mansoni sont émis dès le 2ème mois et mesurent 140 sur 65 µm. De forme ovalaire, ils possèdent un éperon latéral subterminal de grande taille. Le pôle opposé à l’éperon est souvent légèrement rétréci. La coque est simple, épaisse de contour brun clair. L’œuf viable contient un embryon cilié.
Les œufs de S. intercalatum mesurent 200 sur 65 µm. De forme ovalaire, ils possèdent un éperon terminal apical, long de 25 µm se continuant avec la coque de l’œuf. L’extrémité polaire opposée à l’éperon est généralement rétrécie. La coque est simple, épaisse de couleur brun clair et contient un miracidium pour les œufs vivants.
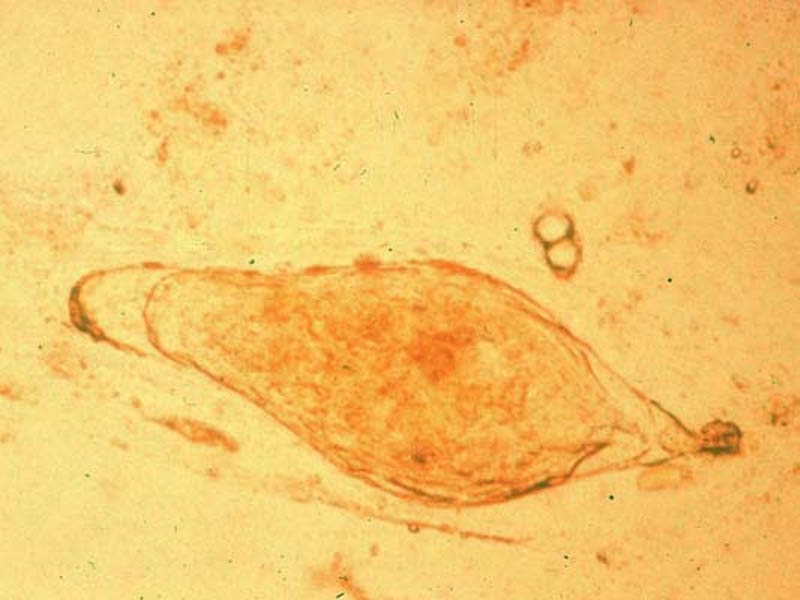
Les œufs de S. japonicum et de S. mekongi sont plus petits et plus sphériques.
Ils mesurent 70 sur 50 µm pour S. japonicum et 60 sur 40 µm pour S. mekongi. Ils présentent latéralement un petit éperon obtus souvent difficile à voir selon l’orientation des œufs. Comme les précédents, la coque est simple, épaisse, brun clair. Les œufs possèdent dès l’émission un embryon cilié.
5 . 2 . 1 . 3 - Les biopsies
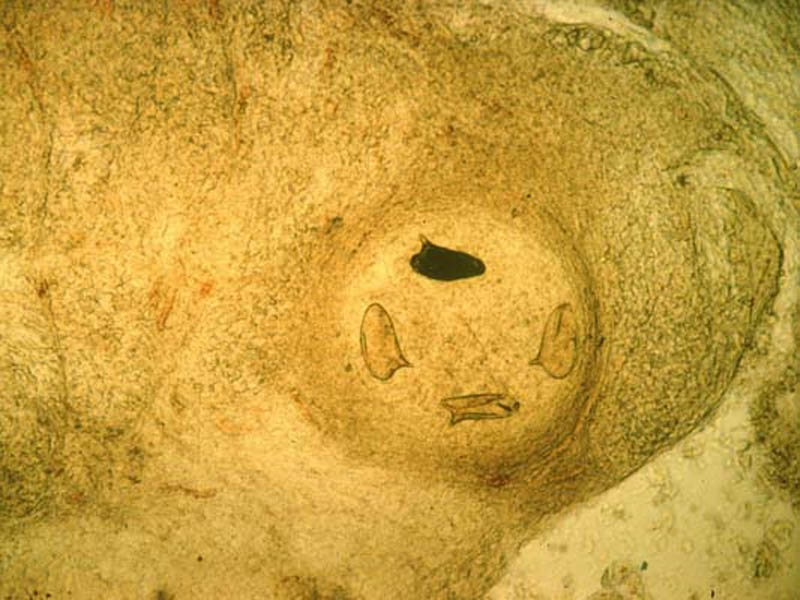
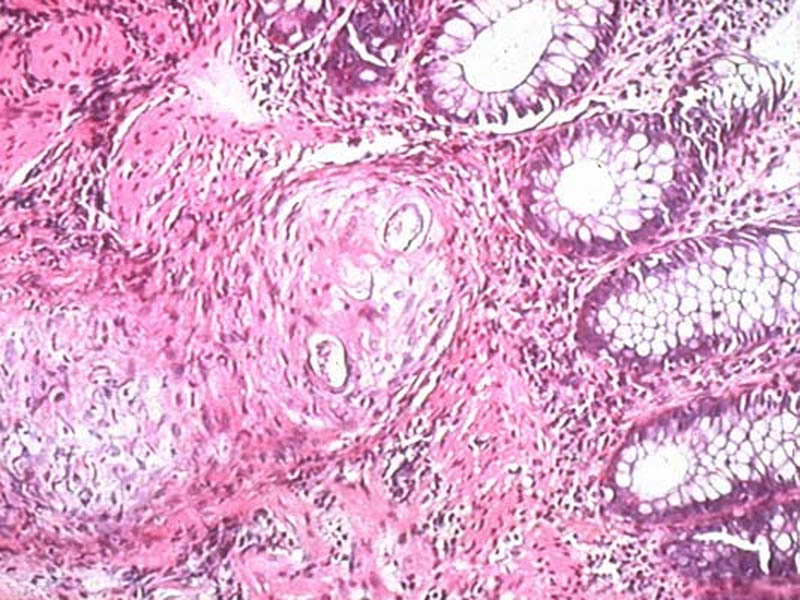
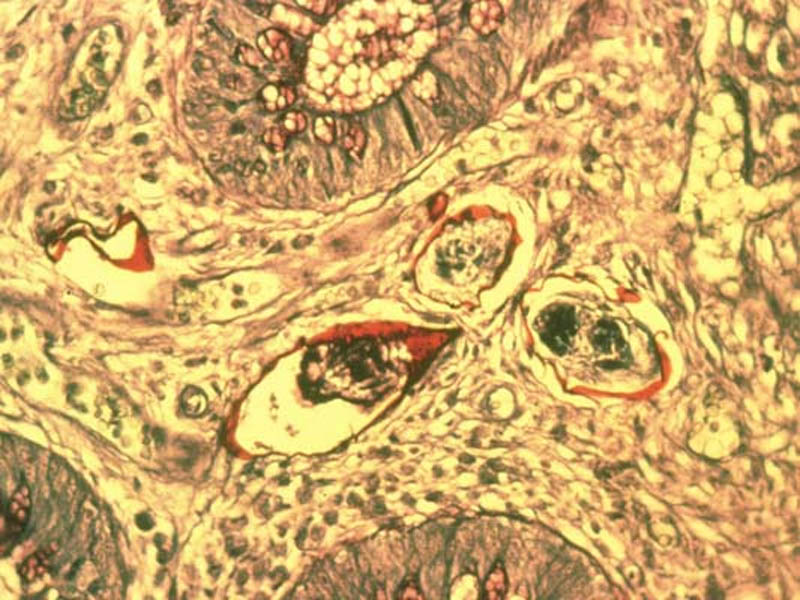
Les biopsies rectales et vésicales peuvent être réalisées au cours de la rectosigmoïdoscopie ou de la cystoscopie. Même en cas de bilharziose uro-génitale, la biopsie rectale est aussi performante et donc préférable à la biopsie vésicale plus traumatisante. Elles doivent être pratiquées lorsque les examens d’urine et de selles sont négatifs. On prélève des petits fragments de muqueuse et de sous-muqueuse, soit au niveau d’une lésion (granulome, ulcération), soit sur le bord d’une valvule de Houston, sans les fixer. Les fragments sont ensuite écrasés entre lame et lamelle et montés dans de la gomme au chloral pour son grand pouvoir éclaircissant, puis examinés au microscope. C’est la forme des œufs et la position de l’éperon qui donnera le diagnostic.
L’examen anatomo-pathologique d’une biopsie rectale, vésicale, hépatique ou d’un autre organe peut retrouver des œufs plus ou moins calcifiés avec une réaction granulomateuse et de nombreux éosinophiles. L’identification sur colorations standard anatomopathologiques est parfois malaisée.
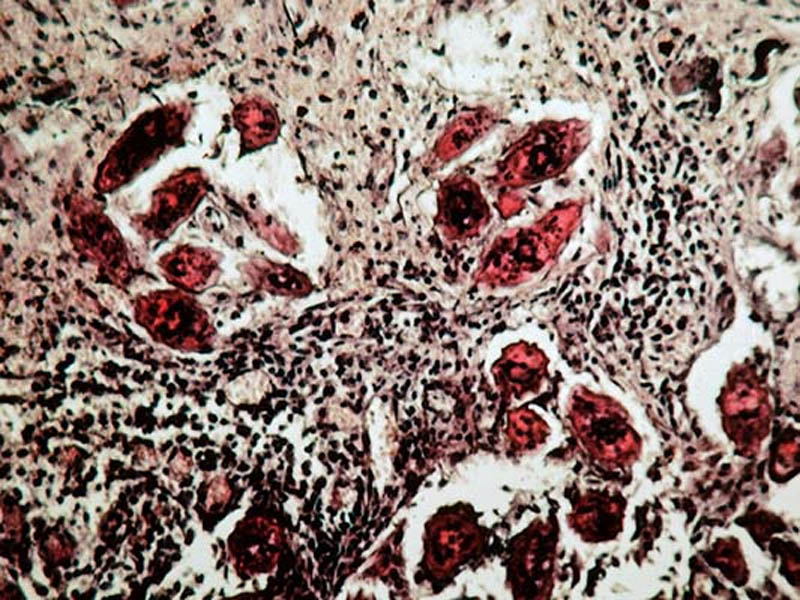
Si l’éperon n’est pas visible en fonction de l’incidence de coupe de l’œuf, il faut avoir recours à la technique de coloration de Ziehl :
- Ziehl positif pour S. mansoni, S. intercalatum, S. japonicum et S. mekongi (coque de l’œuf colorée en rouge)
- Ziehl négatif pour S. haematobium (coque de l’œuf non colorée).
Technique de libération des miracidiums
L’emploi de cette méthode est nécessaire si on veut affirmer une guérison après traitement en différenciant les œufs morts des œufs vivants. Après avoir placé les œufs en milieu hypotonique à 30°C, surveiller à la loupe binoculaire. L’éclosion se produit au bout d’une demi-heure à une heure et le miracidium se met rapidement à nager à la manière d’une paramécie.
8/12