6
-
Inflammation liée aux infections virales
Les virus sont des micro-organismes à parasitisme intracellulaire obligatoire, dotés d’un seul type d’acide nucléique, ADN ou ARN. Ils sont produits par l’assemblage de composants préformés, sont incapables de se diviser et sont dépourvus de l’information génétique nécessaire au développement d’un système capable de générer de l’énergie et de synthétiser des protéines. Ces caractéristiques expliquent que :
la réplication des virus nécessite le détournement de la « machinerie cellulaire » d’une cellule hôte. L’infection d’une cellule par un virus peut déterminer deux types de lésions : des lésions cellulaires directement induites par le virus et des lésions indirectes provoquées par la réponse immunitaire dirigée contre les cellules infectées.
La pénétration des virus dans l’organisme peut se faire par voie digestive (poliomyélite), respiratoire (grippe), cutanée ou muqueuse (herpès, human papilloma virus) et sanguine (hépatite B, VIH) ; enfin le fœtus peut être contaminé à partir de la mère (rubéole).
6
.
1
-
Rappel sur le cycle viral
Attachement du virus à la surface de la cellule
Il relève d’un processus de reconnaissance spécifique de type ligand – récepteur. Le virus reconnaît le plus souvent des protéines membranaires normales de la cellule cible : protéine CD4 de certains lymphocytes pour le VIH, molécule d’adhérence telle que ICAM-1 pour les rhinovirus, l’acide sialique de glycoprotéines pour le virus influenza et les rotavirus.
Entrée dans la cellule
Elle relève le plus souvent des mécanismes généraux d’endocytose, rarement elle est le fait d’une translocation directe du virus ou de mécanismes de fusion de l’enveloppe virale avec la membrane cytoplasmique.
Libération dans le cytoplasme
Sous l’action d’une acidification de l’endosome ou d’enzymes lysosomales, le génome viral est libéré dans le cytoplasme sous forme d’un complexe nucléoprotéique.
La stratégie de réplication du virus dépend de la nature de son matériel génétique
La réplication des virus ADN double brin (human papilloma virus, herpès) ou simple brin (parvovirus) s’effectue au niveau du noyau. Toute la machinerie cellulaire est sollicitée pour répliquer le génome viral et transcrire les gènes codant pour les protéines de structures. La réplication des virus ARN double brin (rotavirus) ou monobrin (lentivirus, entérovirus) est complexe, nécessitant, pour les rétrovirus, une transcription préalable par la transcriptase reverse de l’ARN viral en ADN qui sert de modèle pour la synthèse de nouveaux génomes viraux ARN.
Assemblage du virus
Les virions sont assemblés après réplication du génome viral et synthèse des protéines virales. Le site d’assemblage, cytoplasmique (poxvirus) ou nucléaire (polyomavirus, parvovirus, adénovirus), dépend du site de réplication et des mécanismes de sortie de la cellule.
Sortie de la cellule des virions matures
Elle s’effectue par deux mécanismes : lytique (virus sans enveloppe), la destruction de la cellule libère les virions dans le milieu extra-cellulaire ou par bourgeonnement, le virion est éliminé dans une vésicule constituée de fragments de membrane cytoplasmique (rétrovirus) ou nucléaire (herpès).
Diffusion du virus
Certains virus restent confinés au site primaire de l’infection (papillomavirus). Nombre d’entre eux vont se diffuser dans l’organisme via le système circulatoire (sang et lymphe) au sein duquel ils peuvent être également directement inoculés par effraction traumatique (transfusion, injection intraveineuse de médicaments, piqûre d’insecte). Certains virus résident dans les ganglions nerveux (varicelle) et se meuvent via les axones pouvant réinfecter des cellules épithéliales lors d’une réactivation.
6
.
2
-
Mécanismes de défense contre les affections virales
La peau constitue une barrière efficace contre nombre d’infections virales. Il n’en est pas de même des muqueuses, notamment respiratoires, digestives, génitales, aisément infectées par les virus.
Les macrophages ont une activité antivirale intrinsèque, ils résistent à l’infection virale, toutefois quelques virus peuvent survivre et se répliquer dans les macrophages (VIH, dingue). Ils sont capables de détruire des cellules infectées par les virus (cytotoxicité anticorps dépendante). Ils sont également source de production d’interférons qui confèrent aux cellules non infectées un état de résistance aux virus.
Les lymphocytes représentent la principale ligne de défense antivirale :
- les anticorps produits ont surtout un rôle de protection vis-à-vis d’une réinfection par la même souche. Mais ils favorisent également la phagocytose de particules virales opsonisées et la lyse par les cellules natural killer des cellules infectées recouvertes d’anticorps ;
-
les lymphocytes T ont un rôle essentiel dans la guérison des affections virales. Les cellules T cytotoxiques, générées en réponse à l’expression d’antigènes viraux à la surface des cellules (dont la reconnaissance nécessite l’expression simultanée des antigènes HLA de classe 1) détruisent les cellules infectées en induisant leur entrée en apoptose par deux mécanismes : le système Fas Ligand/Fas et/ou la production de cytotoxines (granzymes et perforine).
Les virus ont développé des stratégies variées pour échapper aux mécanismes de défense immunitaire. La mutation fréquente du génome viral est l’une des plus utilisée (VIH, hépatite C) obligeant le système immunitaire à une adaptation permanente et en limitant l’efficacité. L’infection de cellules exprimant faiblement les antigènes HLA de classe 1 (neurones) ou l’induction d’une inhibition de leur expression par les cellules infectées (cytomégalovirus), l’inhibition de la présentation des antigènes viraux à la surface de la cellule (herpès virus), la déplétion en cellules CD4 (VIH) et la diminution de la production de cytokines pro-inflammatoires sont autant de mécanismes d’échappement.
6
.
3
-
Lésions directes dues aux virus
Les lésions directes dues aux virus peuvent prendre plusieurs aspects, rassemblés sous le terme d’effet cytopathogène (voir ci-après).
Fusion membranaire avec production de cellules géantes plurinucléées
Les glycoprotéines de l’enveloppe ont un rôle clé dans la fusion cellulaire qui peut être observée au cours de la rougeole (figure 3.63) (cellules de Warthin-Finkeldey), des affections à paramyxovirus (le virus de Sendai a été utilisé pour les fusions cellulaires pour la production des anticorps monoclonaux), de l’herpès (HSV-HHV-1) et du sida (la glycoprotéine gp41 est responsable de la fusion des lymphocytes infectés). Ces cellules géantes ont une durée de vie courte mais assurent la propagation directe de cellules à cellules du virus qui échappe ainsi au système de surveillance immunitaire.
Corps d’inclusion
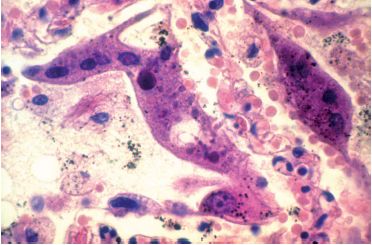
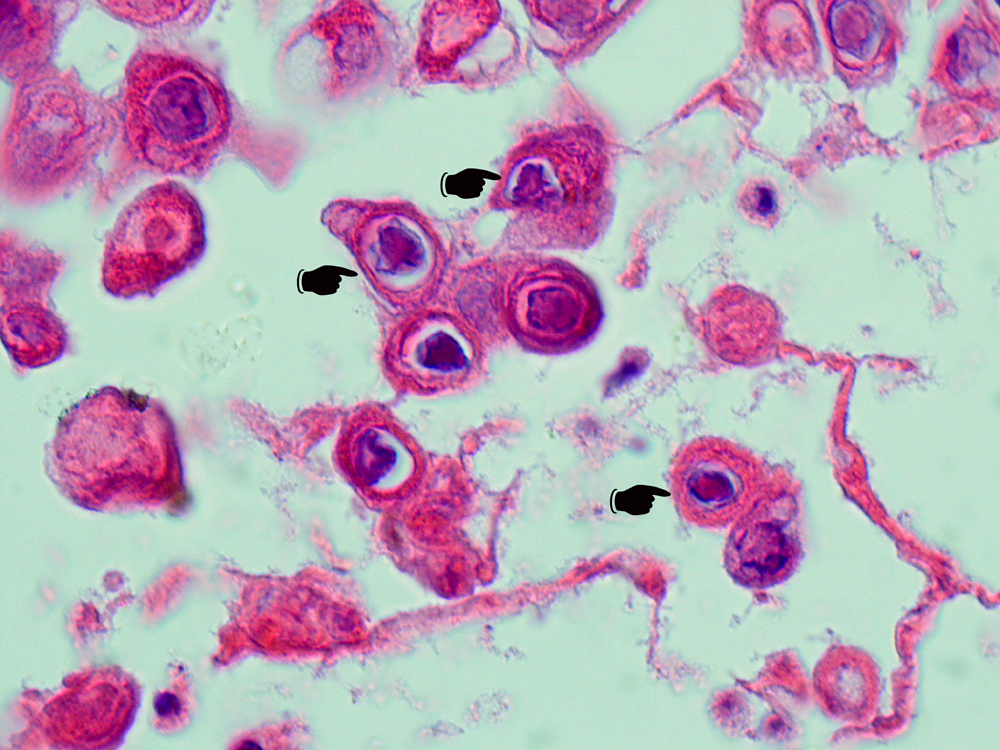
Ce sont des structures correspondant à une accumulation de matériel viral, pour certaines reflétant une organisation cristalline du virus. Ils sont fréquemment observés au cours des maladies virales s’accompagnant de lyse cellulaire : herpès (figure 3.64), rage. Les inclusions de la maladie des inclusions cytomégaliques sont volumineuses intranucléaires et/ou intracytoplasmiques, dans des cellules de grande taille (figure 3.65).
Lyse cellulaire
Elle n’est le fait que d’un nombre limité de souches virales. Elle favorise la propagation des virus qui sont ainsi libérés en grande quantité dans le milieu extra-cellulaire. La lyse cellulaire relève de mécanismes variés et complexes tel que l’arrêt brutal de la synthèse de macromolécules nécessaires au métabolisme cellulaire par interférence des protéines virales avec la transcription (protéines 2A du polyovirus) et la production d’une protéase à fonction toxine-like (protéine penton des adénovirus).
La souffrance cellulaire peut être moins brutale, se traduisant par une ballonisation cellulaire (modification de la perméabilité membranaire), une rupture des structures d’amarrage, intercellulaire et à la matrice extra-cellulaire (altération du cytosquelette).
10/14