2
-
Déroulement général des différentes étapes de la réaction inflammatoire
La réaction inflammatoire est un processus dynamique comportant plusieurs étapes successives : la réaction vasculo-exsudative, la réaction cellulaire, la détersion, la phase terminale de réparation et cicatrisation.
2
.
1
-
Réaction vasculo-exsudative
Elle se traduit cliniquement par :
- quatre signes cardinaux classiques de l’inflammation aiguë : rougeur, chaleur, tuméfaction, douleur ;
- elle comporte trois phénomènes : une congestion active, un œdème inflammatoire, une diapédèse leucocytaire.
Congestion active
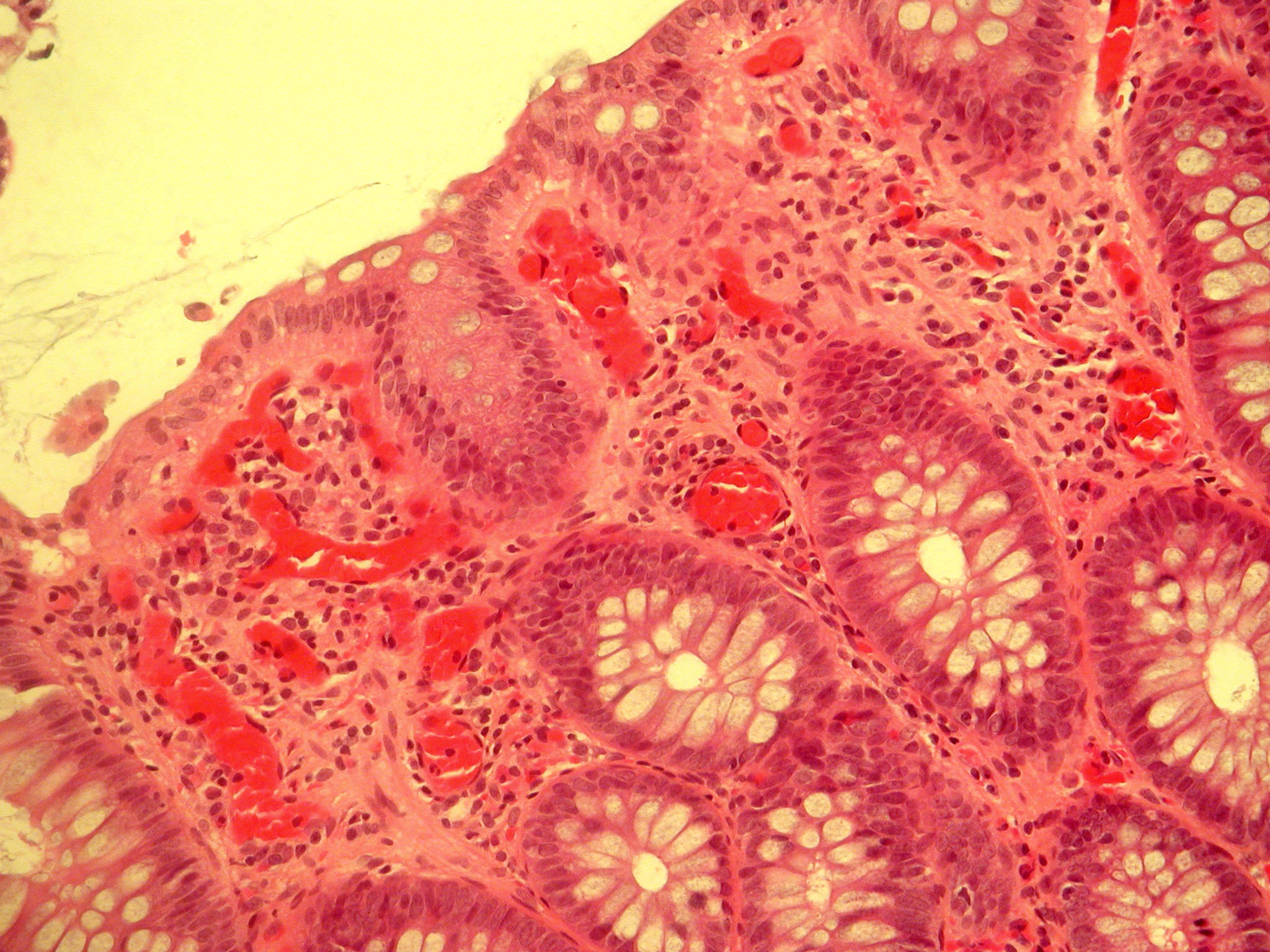
Il s’agit d’une vasodilatation artériolaire puis capillaire dans la zone atteinte (figure 3.1). Localement, il en résulte une augmentation de l’apport sanguin et un ralentissement du courant circulatoire. La congestion est déclenchée rapidement par un mécanisme nerveux (nerfs vasomoteurs) et l’action de médiateurs chimiques.
Œdème inflammatoire
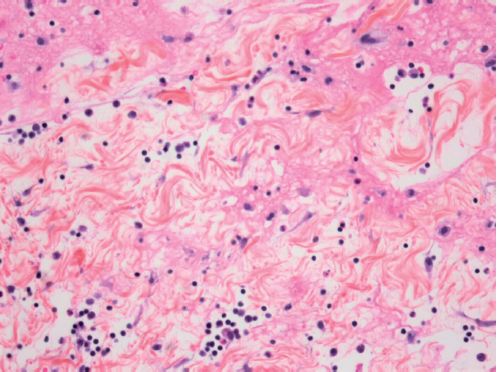
L’œdème inflammatoire résulte du passage dans le tissu conjonctif interstitiel ou les cavités séreuses d’un liquide appelé exsudat constitué d’eau et de protéines plasmatiques.
Sa traduction clinique est un gonflement des tissus qui, en comprimant des terminaisons nerveuses, est responsable de la douleur (également provoquée par certains médiateurs chimiques). Sa traduction microscopique est un aspect pâle, peu colorable et distendu du tissu conjonctif (figure 3.2).
L’œdème inflammatoire résulte d’une augmentation de la pression hydrostatique due à la vasodilatation et surtout d’une augmentation de la perméabilité de la paroi des petits vaisseaux sous l’effet de médiateurs chimiques.
Rôle et conséquences de l’œdème :
- apport local de médiateurs chimiques et de moyens de défense (immunoglobulines, facteurs de la coagulation, facteurs du complément) ;
- dilution des toxines accumulées dans la lésion ;
- limitation du foyer inflammatoire par une barrière de fibrine (provenant du fibrinogène plasmatique), ce qui évite la diffusion de micro-organismes infectieux ;
- ralentissement du courant circulatoire par hémoconcentration, ce qui favorise le phénomène suivant : la diapédèse leucocytaire.
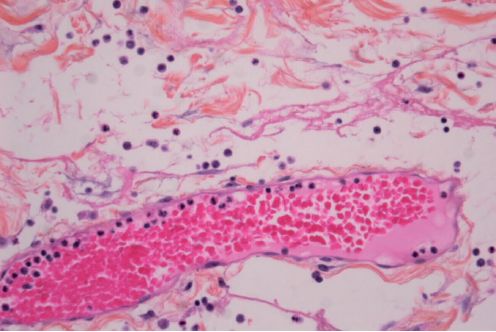
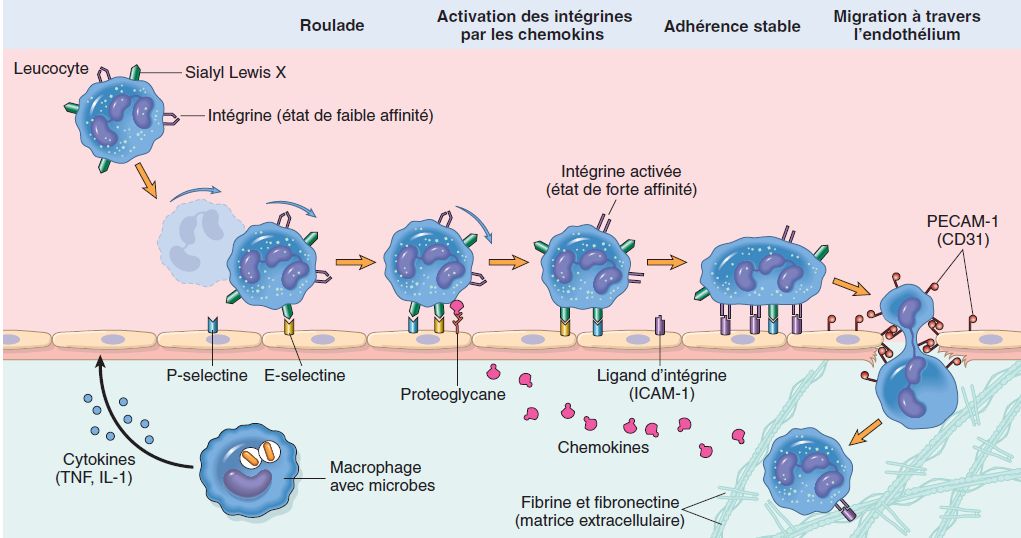
Diapédèse leucocytaire
La diapédèse leucocytaire correspond à la migration des leucocytes en dehors de la microcirculation et leur accumulation dans le foyer lésionnel (figure 3.3).
Elle intéresse d’abord les polynucléaires (pendant les 6 à 24 premières heures), puis un peu plus tard (en 24 à 48 heures) les monocytes et les lymphocytes. Il s’agit d’une traversée active des parois vasculaires qui comporte plusieurs étapes :
-
margination des leucocytes à proximité des cellules endothéliales, favorisée par le ralentissement du courant circulatoire ;
-
adhérence des leucocytes aux cellules endothéliales, par la mise en jeu de molécules d’adhésion présentes sur la membrane des leucocytes et sur l’endothélium ;
-
passage trans-endothélial des leucocytes. Les leucocytes émettent des pseudopodes qui s’insinuent entre les jonctions intercellulaires des cellules endothéliales puis traversent la membrane basale grâce à une dépolymérisation transitoire provoquée par leurs enzymes.[Schéma 3.1]
2
.
2
-
Réaction cellulaire
La réaction cellulaire se caractérise par la formation du granulome inflammatoire ou tissu de granulation inflammatoire.
Composition cellulaire
Le foyer inflammatoire s’enrichit rapidement en cellules provenant du sang ou du tissu conjonctif local.
-
Du sang : polynucléaires, monocytes et lymphocytes. Après diapédèse, ces leucocytes quittent le territoire péri-vasculaire et migrent vers le foyer lésionnel par chimiotactisme. Les agents chimiotactiques, produits par les tissus altérés, par des bactéries et par les leucocytes déjà présents dans le foyer inflammatoire, se fixent sur des récepteurs membranaires des leucocytes, ce qui conduit à l’activation de leur cytosquelette et à leur mobilisation.
-
Du tissu conjonctif local : fibroblastes, cellules endothéliales, mastocytes et macrophages résidents.
Localement certaines cellules vont se multiplier (c’est le cas des fibroblastes, lymphocytes, cellules endothéliales, et à un moindre degré des macrophages) et/ou vont se transformer ou se différencier.
- Accumulation de polynucléaires dont la durée de vie est courte (3–4 jours). Leurs enzymes sont libérées dans le foyer inflammatoire. L’apport de nouveaux neutrophiles doit être soutenu dans les phases initiales de l’inflammation par une production hématopoïétique accrue.
- Les monocytes deviennent des macrophages activés capables de phagocytose, de sécrétion de nombreux médiateurs et de coopération avec les lymphocytes pour le développement de la réaction immunitaire (présentation de molécules antigéniques aux lymphocytes). Leur durée de vie est plus longue que celle des polynucléaires.
- Transformation des lymphocytes B en plasmocytes sécrétant des immunoglobulines ; activation des lymphocytes T : sécrétion de nombreux médiateurs, acquisition de propriétés cytotoxiques et coopération avec les lymphocytes B.
- Modification des fibroblastes en myofibroblastes : acquisition de propriétés contractiles et synthèse des constituants de la matrice extra-cellulaire.
La composition du tissu de granulation varie en fonction du temps (figure 3.4). Les polynucléaires sont le stigmate morphologique de l’inflammation aiguë mais généralement après quelques jours ou semaines d’évolution, le granulome inflammatoire contient plus de cellules inflammatoires mononucléées que de polynucléaires. Il s’agit alors de macrophages et de cellules de la réponse immune (lymphocytes et plasmocytes). Ensuite progressivement, sous l’influence de facteurs de croissance, le tissu de granulation s’enrichit en fibroblastes et en cellules endothéliales formant des néo-vaisseaux. Il est alors également appelé bourgeon charnu. La composition du tissu de granulation varie aussi en fonction de la cause de l’inflammation : un type cellulaire peut prédominer sur un autre.
Rôles du granulome inflammatoire
- Assurer la détersion par les phagocytes (polynucléaires et macrophages).
- Développer une réaction immunitaire lymphocytaire B et/ou T.
- Sécréter de multiples médiateurs intervenant dans le recrutement cellulaire, la phagocytose, la défense immunitaire, et la modification de la matrice conjonctive.
Durant les phénomènes de chimiotactisme et de phagocytose, les leucocytes activés peuvent libérer des métabolites toxiques et des protéases dans l’espace extra-cellulaire, ce qui engendre des lésions tissulaires.
2/14