3
-
Fibroses
3
.
1
-
Définition
La fibrose est une lésion élémentaire du tissu conjonctif définie par l’augmentation des constituants fibrillaires de la matrice extra-cellulaire dans un tissu ou un organe. Elle est une composante fréquente des processus inflammatoires mais peut aussi survenir dans d’autres conditions pathologiques (pathologies vasculaires, métaboliques, tumorales).
La sclérose est l’induration des tissus liée à la fibrose. Il s’agit donc d’un terme macroscopique mais souvent employé comme synonyme de fibrose.
La matrice extra-cellulaire (MEC) est une structure multimoléculaire complexe comprenant des fibres de collagènes, des fibres élastiques, des glycoprotéines de structure dont la fibronectine et la laminine, et des mucopolysaccharides. Il s’agit d’un milieu dynamique, organisé en un réseau tridimensionnel et physiologiquement en équilibre entre les processus de synthèse, de dépôt dans le milieu extra-cellulaire et les processus de dégradation de ces molécules.
La constitution d’une fibrose résulte d’une rupture de l’équilibre de la MEC : augmentation des processus de synthèse et de dépôt des constituants de la MEC d’une part et diminution de leur dégradation d’autre part.
Une fibrose constituée peut rester stable, s’aggraver sous l’action répétée d’agressions tissulaires, ou régresser.
La régression est une évolution rare, concernant des fibroses récentes et nécessitant la disparition du stimulus initial de la fibrogénèse.
3
.
2
-
Circonstances étiologiques des fibroses
Si l’évolution spontanée d’une réaction inflammatoire chronique prolongée est souvent la fibrose, toutes les fibroses ne sont pas pour autant d’origine inflammatoire.
Fibrose au cours des réactions inflammatoires
La fibrose cicatricielle : c’est l’aboutissement du processus inflammatoire déclenché par une agression tissulaire. La cicatrice est un nouveau tissu fibreux qui remplace définitivement les tissus nécrosés pendant l’inflammation.
La fibrose est constante au cours des inflammations chroniques.
Exemples :
- les hépatites chroniques (d’origine virale, auto-immune ou médicamenteuse) présentent au cours de leur évolution l’élaboration d’une fibrose élargissant d’abord les espaces portes puis formant des ponts fibreux (septa) réunissant des espaces portes entre eux ou à des veines centro-lobulaires (figure 3.21) ;
- dans certaines maladies inflammatoires chroniques de cause inconnue, une fibrose mutilante est au premier plan de la maladie et entraîne d’importantes destructions. C’est le cas de la fibrose rétropéritonéale où une fibrose inflammatoire remplace le tissu adipeux rétropéritonéal et comprime la veine cave et les uretères ou bien de la thyroïdite chronique de Riedel où la fibrose détruit la glande thyroïde et s’étend aux tissus mous cervicaux (figure 3.22).
Fibrose dystrophique remplaçant un tissu fonctionnel altéré
- Hypoxie chronique.
- Fibrose atrophique par déficit hormonal (ex : fibrose des ovaires après la ménopause).
- Pathologie métabolique et génétique (ex : développement d’une fibrose hépatique au cours de l’hémochromatose génétique ou d’une fibrose remplaçant les fibres musculaires détruites dans les myopathies congénitales).
- Sénescence (ex : fibrose élastosique du derme ; fibrose intimale de l’artériosclérose).
Fibrose du stroma des cancers
Quand le stroma est très fibreux, il est responsable de l’aspect dur et rétracté de certains cancers.
3
.
3
-
Morphologie macroscopique et microscopique des fibroses
Macroscopie
Un tissu fibrosé est blanchâtre ; plus la fibrose est ancienne, plus le tissu sera de consistance ferme ou dure et plus résistant à la coupe que le tissu normal.
La forme d’un organe très fibrosé est modifiée : parfois organe hypertrophié quand le volume du tissu fibreux est supérieur au volume tissulaire normal qu’il remplace (ex : cicatrice cutanée hypertrophique), plus souvent organe atrophié car le volume du tissu fibreux est inférieur au volume tissulaire normal qu’il remplace. L’atrophie est souvent associée à une déformation de l’organe (fibrose rétractile ou sténosante).
Exemples :
- sténose cicatricielle fibreuse de la paroi œsophagienne après ingestion de caustiques ou œsophagite radique ;
- sténose fibreuse de l’intestin grêle après radiothérapie ;
- rein déformé et atrophique après des infections urinaires répétées ayant détruit des secteurs du parenchyme rénal (pyélonéphrite chronique) ;
- sténose de la dernière anse iléale atteinte par une maladie de Crohn (maladie chronique intestinale associant inflammation et fibrose pan-pariétale) (figure 3.23).
Microscopie
Les aspects microscopiques des fibroses sont variables.
Selon l’ancienneté de la fibrose
- Fibrose récente en voie de constitution (figure 3.24) : fibrose « lâche » riche en MEC non fibrillaire (prédominance de mucopolysaccharides), fibres de collagène peu épaisses et peu condensées (surtout de type III et IV), nombreux fibroblastes et myofibroblastes, présence de leucocytes de la réaction inflammatoire.
- Fibrose ancienne (figure 3.25) : fibrose dense, riche en fibres collagènes épaisses et condensées (surtout de type I) avec peu de cellules et moins de substance fondamentale hydrosoluble.
Selon sa composition biochimique
- Fibrose riche en fibres élastiques : certaines fibroses pulmonaires (figure 3.26), élastose du derme au cours de la sénescence et sur les zones cutanées exposées aux rayons ultraviolets (figure 3.27) et stroma élastosique de certains cancers du sein.
- Fibrose « réticulinique » (figure 3.28) colorée par les sels d’argent, riche en collagène de type III dans la moelle osseuse ou les ganglions lymphatiques.
- Fibrose « hyaline » : collagène dense, d’aspect microscopique homogène et vitreux, prenant fortement les colorants, dans des fibroses anciennes ou les chéloïdes.
Selon sa topographie
- Fibrose systématisée : la fibrose reste limitée à la charpente conjonctive normale du tissu ; cette charpente conjonctive apparaît donc épaissie mais l’architecture du tissu reste reconnaissable. Exemple : dans le poumon, fibrose épaississant les cloisons interlobulaires et les cloisons alvéolaires (figure 3.29). Quand elle est étendue à l’ensemble du tissu pulmonaire, cette fibrose conduit à l’insuffisance respiratoire par perturbation des échanges gazeux.
- Fibrose mutilante : remplace le tissu normal et donc détruit son architecture. Elle peut être localisée (ex : cicatrice d’un infarctus, socle d’un ulcère gastrique chronique ou enkystement d’un abcès) ou diffuse à tout un organe (ex : pancréatite chronique). Elle peut s’élaborer d’emblée en cas de destruction tissulaire abondante ou être l’évolution terminale d’une fibrose systématisée.
 Un exemple de fibrose mutilante : la cirrhose hépatique .
Un exemple de fibrose mutilante : la cirrhose hépatique .
5/14






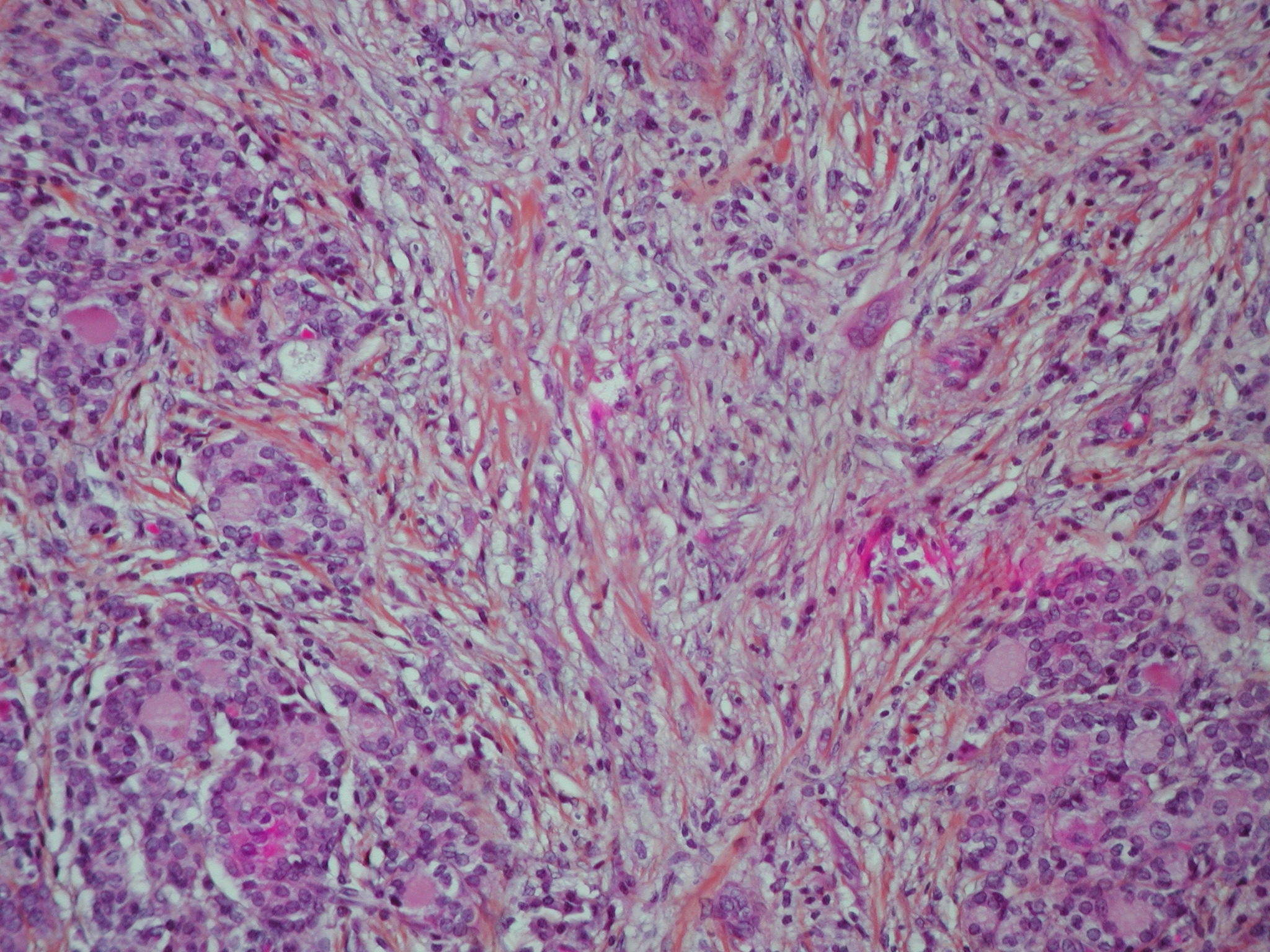
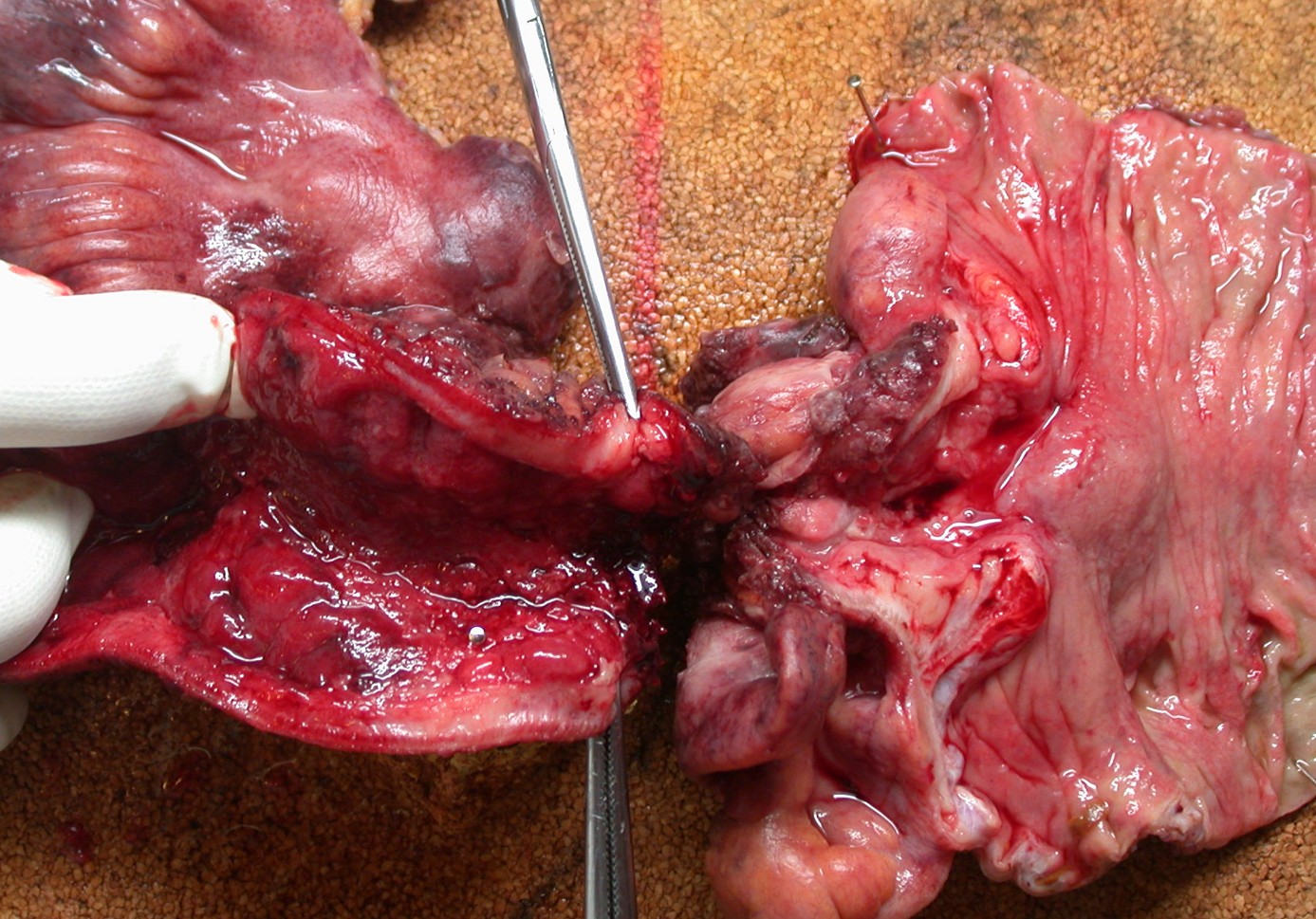
 Un exemple de fibrose mutilante : la cirrhose hépatique
Un exemple de fibrose mutilante : la cirrhose hépatique