2
.
5
-
Variétés morphologiques des inflammations aiguës et chroniques
Variétés d’inflammations aiguës
Inflammation congestive et œdémateuse
Elle est caractérisée par une vasodilatation intense et un exsudat particulièrement abondant.
Exemples :
- réaction allergique au niveau de la muqueuse nasale ou du larynx (hypersensibilité de type I anaphylactique) ;
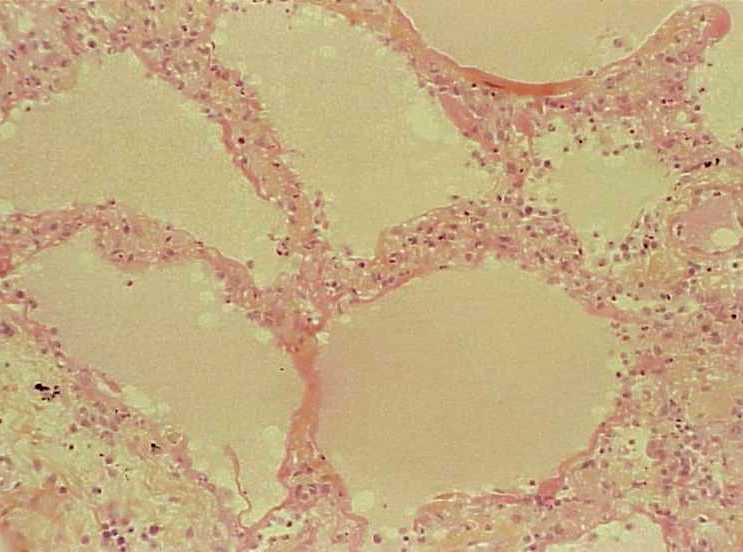
- œdème aigu du poumon au cours d’une infection virale (figure 3.7).
La gravité est fonction de l’organe touché. L’évolution est habituellement résolutive sans séquelle.
Inflammation hémorragique
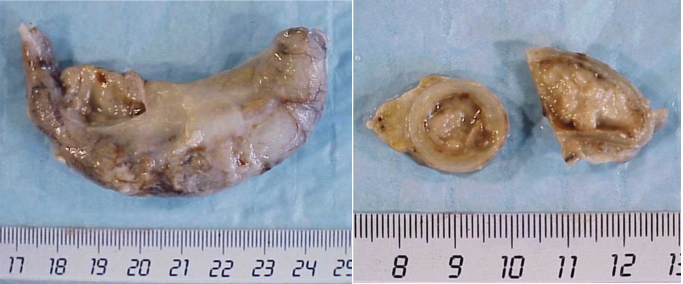
Extravasation de globules rouges (érythrodiapédèse) par augmentation exagérée de la perméabilité capillaire et altération des cellules endothéliales ou bien ulcérations d’une muqueuse et de ses vaisseaux.
Exemples :
- infections virales (pneumonies, encéphalite, etc.) ;
- purpura d’une septicémie à méningocoque ;
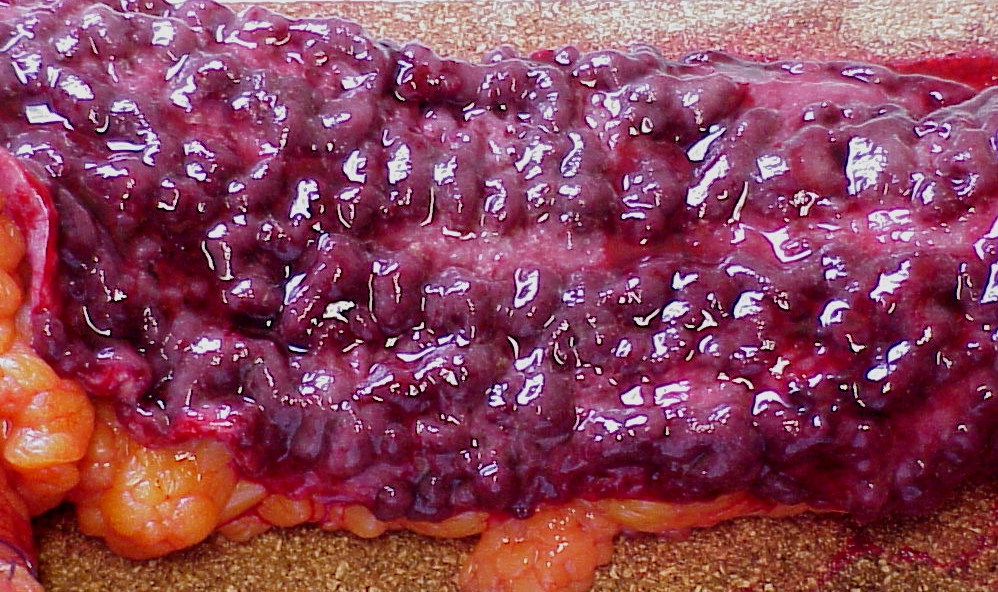
- poussée aiguë d’une rectocolite ulcéro-hémorragique (figure 3.8).
Inflammation fibrineuse
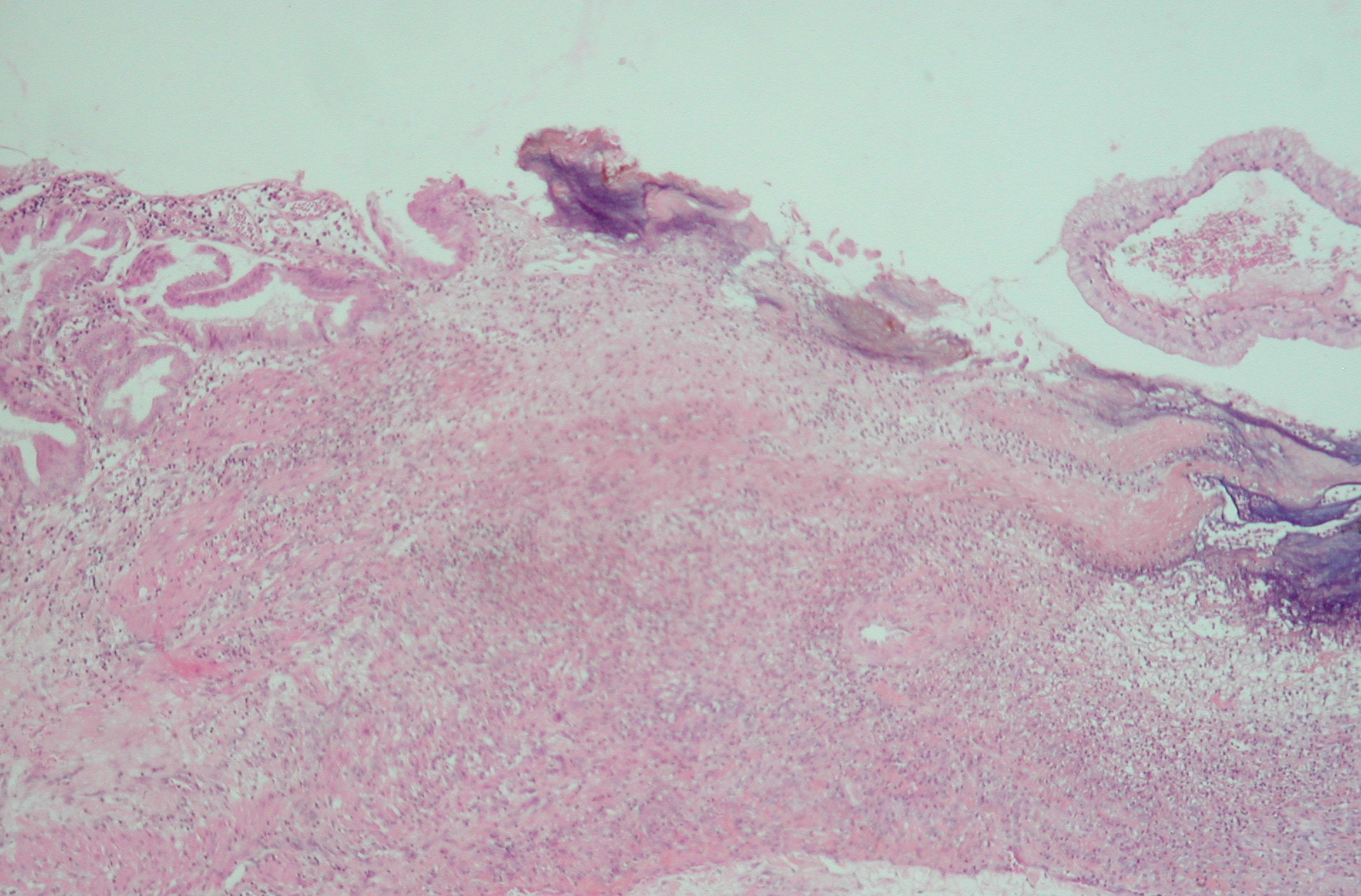
Elle est caractérisée par un exsudat très riche en fibrinogène qui se coagule en un réseau de fibrine. L’aspect macroscopique est celui de filaments blanchâtres, très fins ou épais (appelés aussi « fausses membranes »), souvent déposés à la surface d’une séreuse (figures 3.9, 3.10). Dans le poumon, les dépôts de fibrine forment les « membranes hyalines » tapissant l’intérieur des parois alvéolaires dans diverses pneumonies aiguës.
L’évolution se fait soit avec une lyse complète de la fibrine par les enzymes des polynucléaires et une guérison sans séquelle, soit avec une détersion incomplète de la fibrine. Dans ce cas, un tissu fibreux va progressivement remplacer la fibrine. Ce phénomène appelé « organisation » conduit à des adhérences fibreuses focales des séreuses, les brides, ou à une adhérence diffuse des feuillets séreux appelée symphyse pleurale ou péricardique (figure 3.11). Dans les poumons, l’organisation fibreuse de membranes hyalines peut conduire à un épaississement fibreux des parois alvéolaires (fibrose systématisée) ou à un comblement fibreux des alvéoles (fibrose mutilante).
Inflammation thrombosante
Des caillots sanguins oblitérant les petites veines et artères sont possibles dans tout foyer inflammatoire et tout particulièrement quand il existe une lésion directe des parois vasculaires ou de l’endocarde.
Exemples :
- vascularite systémique : atteinte vasculaire des rejets aigus de greffe rénale ;
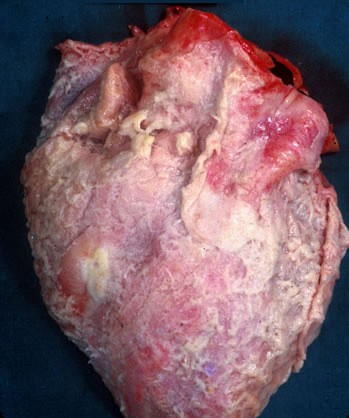
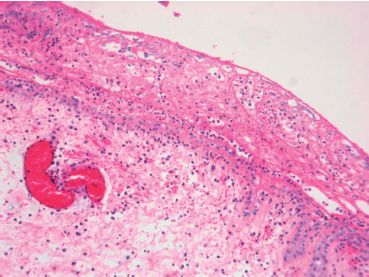
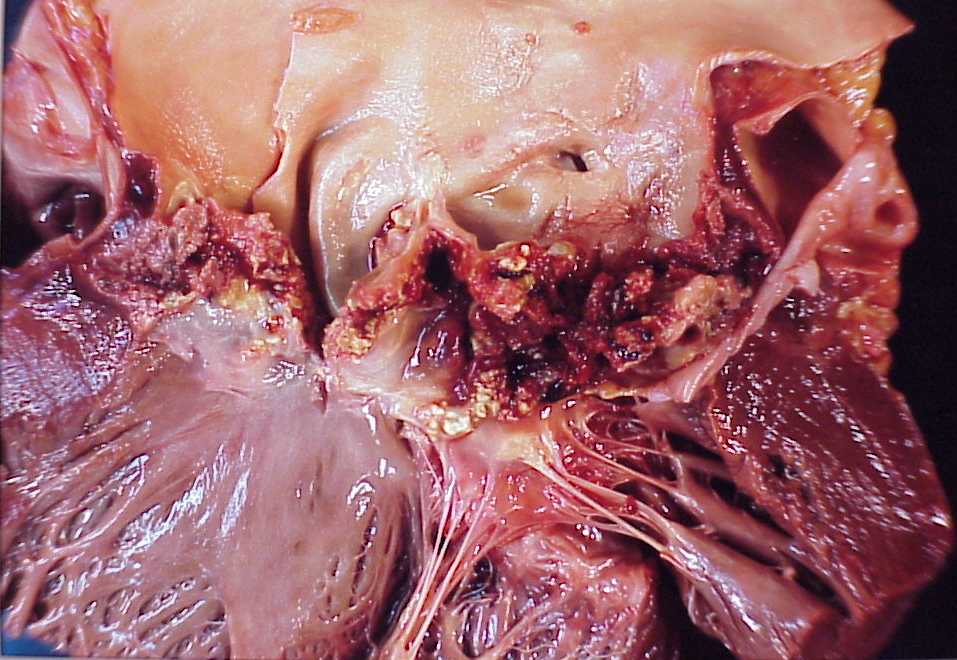
- endocardites infectieuses : les valves cardiaques sont ulcérées et recouvertes de thrombus friables et septiques (appelés végétations) (figure 3.12).
Inflammation purulente ou suppurée
Elle est caractérisée par la présence massive de pyocytes (polynucléaires altérés).
L’inflammation suppurée est le plus souvent secondaire à une infection par des bactéries dites pyogènes (staphylocoque, streptocoque, pneumocoque, etc.) (figure 3.13). Elle peut être aseptique, après arrivée massive de polynucléaires dans un site inflammatoire et la libération massive de leurs enzymes.
L’inflammation suppurée peut se rencontrer sous plusieurs formes : pustule, abcès, phlegmon ou empyème.
- Pustule : accumulation de pus dans l’épaisseur de l’épiderme ou sous l’épiderme décollé.
- Abcès : inflammation suppurée localisée creusant une cavité dans un organe plein (
 Morphologie et évolution d'un abcès).
Morphologie et évolution d'un abcès).
- Phlegmon : suppuration diffuse non circonscrite, s’étendant le long des gaines tendineuses, ou dans le tissu conjonctif entre les aponévroses et entre les faisceaux musculaires des membres.
Il s’observe lors d’infection par des bactéries secrétant en grande quantité des enzymes dégradant le tissu conjonctif (hyaluronidase du streptocoque hémolytique). L’inflammation s’étend sans se collecter et a peu de chance d’être détergée. Le phlegmon évolue donc fréquemment vers la chronicité avec formation d’une fibrose.
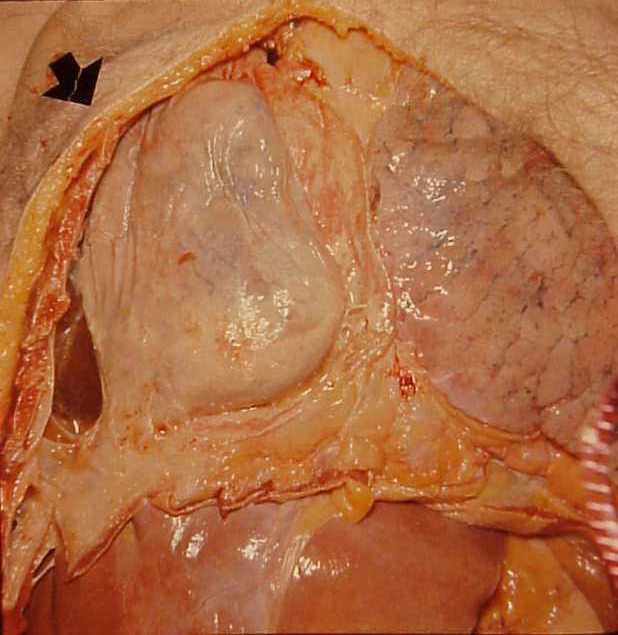
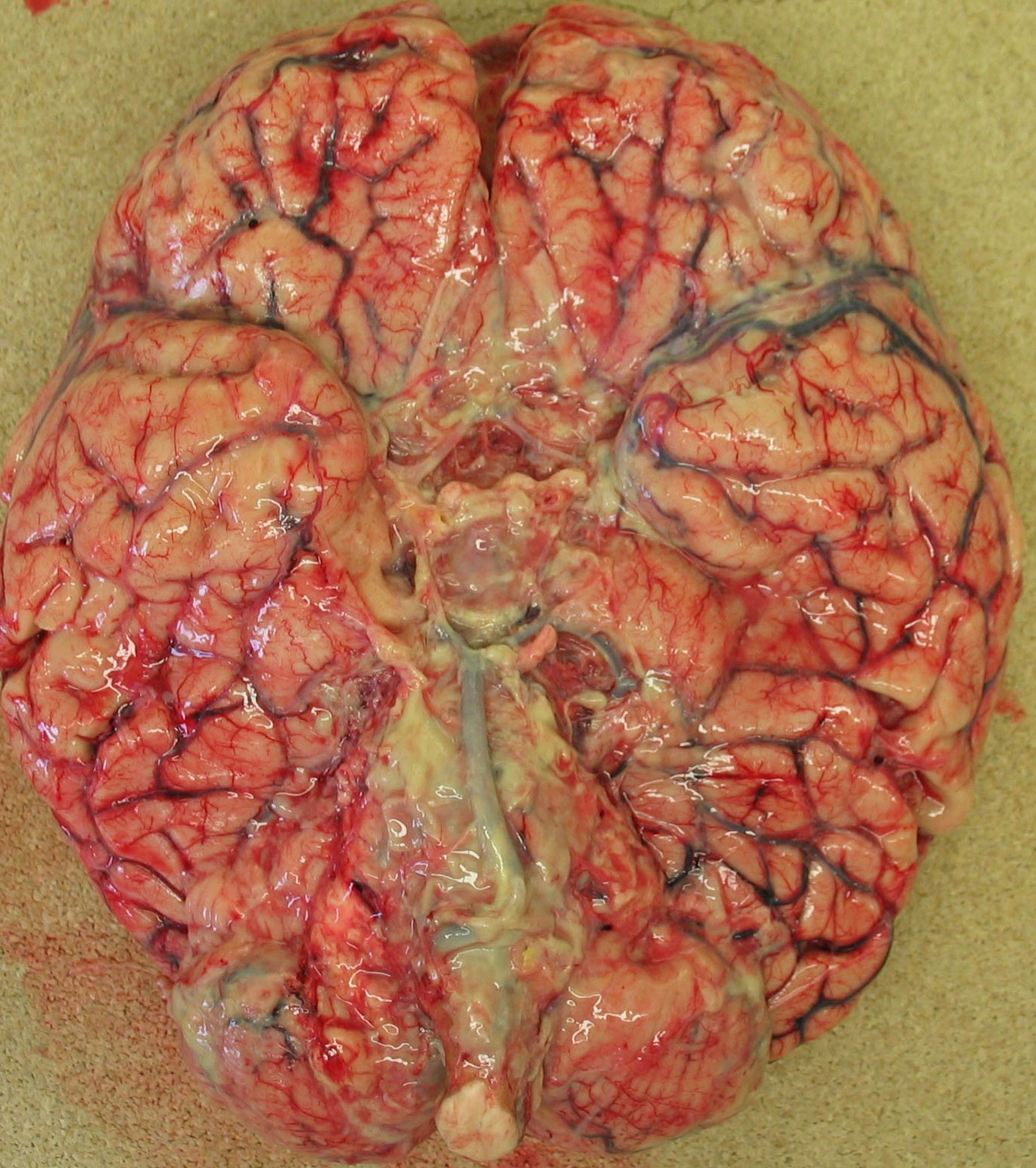
- Empyème : suppuration collectée dans une cavité naturelle préexistante. Par exemple : cavités séreuses (figure 3.14), articulations (arthrite), sinus (sinusite), trompe (pyo-salpinx), vésicule biliaire (pyo-cholécyste), appendice (pyo-appendicite) (figure 3.15), espace limité par les méninges (empyème sous-dural).
Inflammation gangréneuse
La gangrène est caractérisée par une nécrose tissulaire extensive due à des bactéries anaérobies (libération de toxines, de collagénases) et/ou à des thromboses dans le foyer inflammatoire (source de nécrose ischémique), les deux mécanismes étant souvent étroitement intriqués. Généralement, l’altération de l’état général est sévère.
Exemples :
- cholécystite gangréneuse (figure 3.16) ou appendicite gangréneuse, avec un risque important de perforation de ces organes et de péritonite ;
- gangrène gazeuse par infection d’une plaie.
Variétés d’inflammations chroniques
Dans les inflammations de longue durée évoluent simultanément une inflammation active, des destructions tissulaires et une tentative de réparation.
Caractères morphologiques communs aux inflammations chroniques
- Peu ou pas de phénomènes exsudatifs, sauf en cas de poussée inflammatoire aiguë émaillant une évolution chronique (ex : la synovite de la polyarthrite rhumatoïde présente, lors des poussées actives de la maladie, un abondant exsudat fibrineux intra-articulaire, des ulcérations du revêtement synovial et un afflux de polynucléaires).
- Le granulome inflammatoire contient peu ou pas de polynucléaires neutrophiles et est constitué principalement de cellules mononucléées : lymphocytes, plasmocytes, monocytes-macrophages, fibroblastes, parfois avec des polynucléaires éosinophiles ou basophiles et des mastocytes. La proportion de ces différentes cellules est variable selon l’étiologie de l’inflammation : prédominance de lymphocytes et plasmocytes dans certaines maladies auto-immunes (ex : thyroïdite lymphocytaire) ou dans des pathologies virales (ex : hépatite chronique liée au virus C) ; prédominance de monocytes-macrophages dans certaines infections chroniques et dans les réactions à corps étrangers. Les monocytes-macrophages peuvent prendre des aspects morphologiques particuliers :
- granulomes épithélioïdes et gigantocellulaires ;
- nappes extensives de macrophages surchargés de phagolysosmes et bactéries mal dégradées dans les infections s’accompagnant de troubles de la bactéricidie (telles qu’une malacoplakie ou une maladie de Whipple) ;
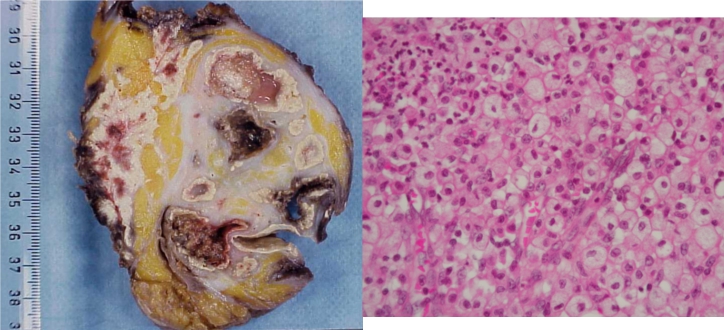
- inflammation xanthogranulomateuse : variété d’inflammation chronique où le foyer inflammatoire est macroscopiquement jaunâtre et en microscopie riche en lipophages (macrophages ayant phagocyté des lipides, présentant un large cytoplasme clair « spumeux ») ; elle se rencontre en particulier dans le rein (figure 3.17), la vésicule biliaire et le sein ;
- développement constant d’une fibrose, systématisée ou mutilante.
Variétés pathologiques de la réparation/cicatrisation
-
Plaie atone : le tissu de granulation inflammatoire est déficient, entraînant un bourgeon charnu atrophique pauvre en capillaires sanguins. La cicatrisation est alors impossible. Exemple fréquent : diabète avec neuropathie et troubles de la micro-circulation locale.
-
Bourgeon charnu hyperplasique (synonyme : pseudo botryomycome) : développement excessif d’un bourgeon charnu hypervascularisé, lié à des facteurs locaux irritatifs ou infectieux.
-
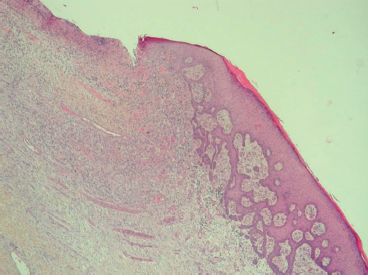
Hyperplasie épithéliale au pourtour d’un foyer inflammatoire : cette hyperplasie de l’épiderme ou d’un revêtement muqueux peut parfois simuler une tumeur, cliniquement et microscopiquement (hyperplasie pseudo-épithéliomateuse) (figure 3.18).
-
Cicatrice hypertrophique : excès de tissu conjonctif collagène par excès d’activité des myofibroblastes. Cette cicatrice hypertrophique a tendance à s’atténuer au cours du temps, à la différence de la chéloïde qui persiste ou augmente de volume au cours du temps.
-
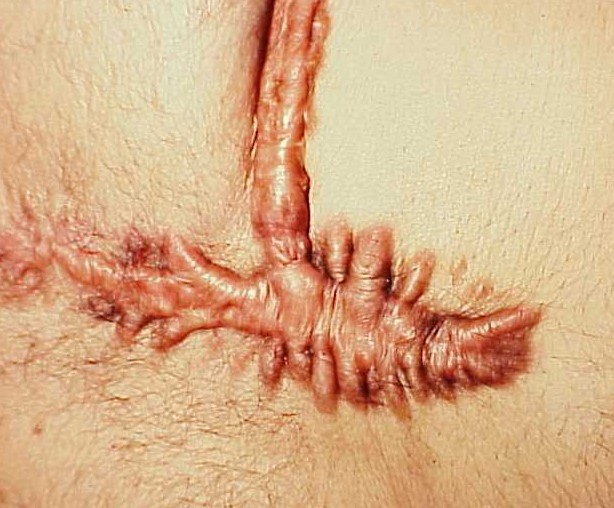
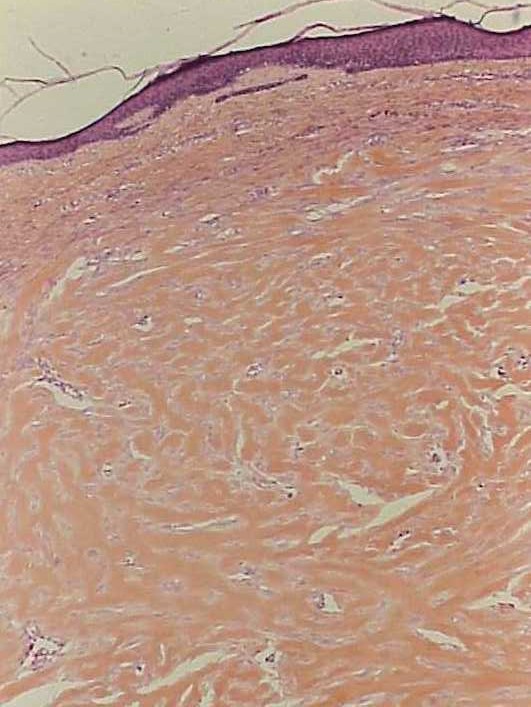
Chéloïde : il s’agit d’une lésion hypertrophique du tissu conjonctif du derme survenant après une plaie ou spontanément (figure 3.19). Elle est constituée de gros trousseaux anormaux de collagène (collagène dit « hyalin » très dense aux colorants) (figure 3.20) et résulte d’une dérégulation de la synthèse de la matrice extra-cellulaire sur un terrain génétiquement prédisposé (prédominance dans la race noire). Une chéloïde peut récidiver après une exérèse chirurgicale.
-
Cicatrice rétractile : exagération du processus normal de contraction du tissu fibreux cicatriciel. Elle survient le plus souvent après des traumatismes sévères (brûlures profondes) au niveau des plantes et des paumes ou du thorax, et peut gêner la mobilité articulaire.
4/14






 Morphologie et évolution d'un abcès
Morphologie et évolution d'un abcès