- Pré-requis et Objectifs
-
Cours
- Contenu
- Points essentiels
-
Version PDF

- Evaluations
- Annexes
8 - Diagnostic biologique
8 . 1 - Diagnostic direct
La mise en évidence des trypanosomes dans le sang est habituellement aisée en phase aiguë (à frais, sur frottis et GE colorés par le MGG, si possible après fixation dans le liquide d’Errecart ou après centrifugation en tube capillaire). Les trypanosomes, très mobiles, sont retrouvés à l'interface hématies-plasmas.
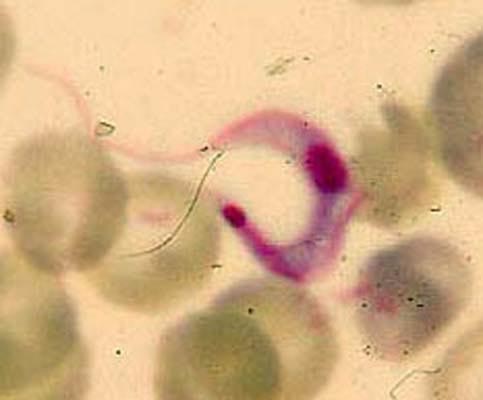
Figure 14 : T. cruzi, forme longue
Assez souvent, Trypanosma cruzi est retrouvé dans le LCR, associé ou non à une symptomatologie neurologique.
Passés les deux ou trois premiers mois de l'infection, la parasitémie devient indétectable par les moyens précités. Trois techniques peuvent alors être utilisées: le xénodiagnostic, la culture du sang sur milieu de LIT ou BHI et l'amplification génomique par PCR.
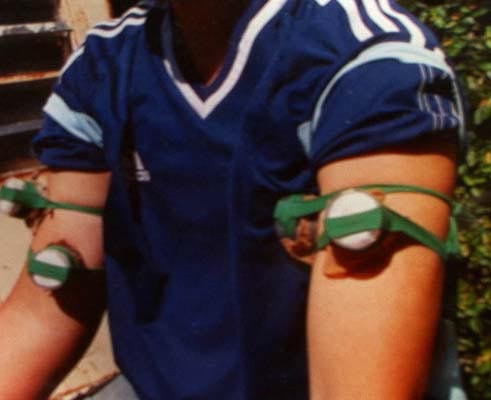
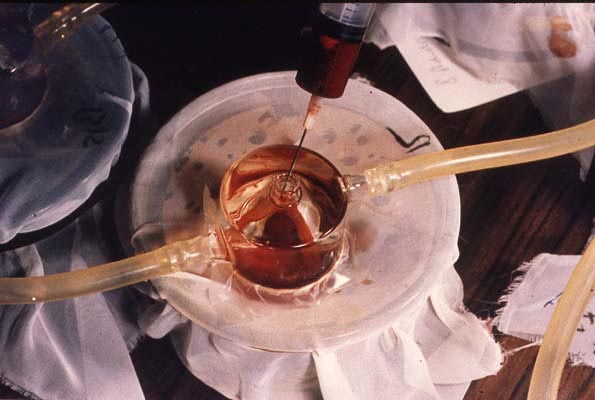
Malgré son côté artisanal, le xénodiagnostic de Brumpt continue d'être pratiqué en zone d'endémie en raison de son efficacité. Son principe est celui d'une culture in vivo obtenue en faisant piquer le sujet suspect par un certain nombre de vecteurs d’élevage, donc forcément sains puisqu’il n’y a pas de transmission congénitale de l’infection chez l’insecte. Les quelques variantes qui ont été introduites dans le protocole original portent sur l'espèce, le stade, le nombre des insectes utilisés, ainsi que sur le temps au bout duquel le parasite est recherché dans les déjections ou l'intestin des triatomes, ainsi que la technique avec laquelle cette recherche est effectuée. Dans la variante dite "artificielle", les insectes, au lieu d'être alimentés directement sur le malade, le sont à travers une membrane fermant une cloche à double corps contenant le sang à tester maintenu à 37° C.
Cloche de verre à double corps destinée à recevoir le sang à tester (xénodiagnostic artificiel)
Les hémocultures sur milieu de LIT ou sur BHI (infusion cœur-cervelle) sont longues (1 à 3 mois) et lourdes à mettre en œuvre car elles nécessitent un grand nombre de repiquages. Elles en sont que rarement utilisées à des fins diagnostiques.
Les techniques de PCR sont basées sur l'amplification d'une séquence soit du DNA kinétoplasmatique (kDNA-PCR), soit d'un segment répétitif d'une séquence de 195 paires de bases du DNA nucléaire. La kDNA-PCR est un peu moins spécifique que la DNA-PCR et plus tributaire du polymorphisme des souches. La PCR permet de rechercher le parasite aussi bien dans le sang ou les tissus humains et animaux que dans les déjections et dans le contenu intestinal des triatomes. Sa sensibilité est hélas médiocre, comprise entre 60 et 70 % en phase chronique. En revanche, elle est proche de 100% dans les infections néo-natales.
8 . 2 - Diagnostic indirect
Les techniques les plus couramment utilisées sont l'IFI IgG/IgM, l'ELISA IgG/gM. L' IFI qui est la première des réactions à se positiver, entre le 12 ième et 20 ième jour pour l'IFI IgM, est également la technique de référence, avec une sensibilité de 98/99 %. L'ELISA sur lysat de formes épimastigotes ou trypomastigotes a une sensibilité voisine ou très légèrement supérieure à celle de l'IFI. Il existe des réactions croisées entre T. cruzi, Leishmania spp et Trypanosoma rangeli , plus fréquente avec l’IFI et l’ELISA qu’avec l’HAI. Pour la confirmation d’un diagnostic clinique ou le suivi après traitement, au moins deux techniques différentes doivent être utilisées.
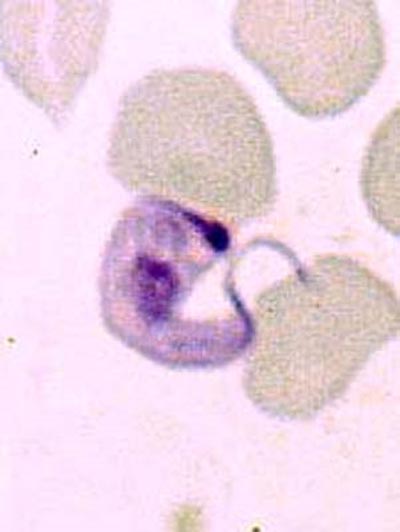
T. rangeli
T. rangeli est un trypanosome qui peut être rencontré dans le sang des chagasiques. Sa morphologie diffère de celle de T cruzi. Il est une fois et demi plus long avec un petit blépharoplaste. Il est considéré comme un parasite non pathogène et transmis essentiellement par la piqûre de certains triatomes, surtout ceux appartenant au genre Rhodnius, qui transmettent également Trypanosoma cruzi. Trypanosoma rangeli interagit probablement avec Trypanosoma cruzi dans les cas d'infections mixtes chez l'homme, soit de façon négative, en facilitant l'expression du pouvoir pathogène de T.cruzi, soit de manière positive, en induisant un certain degré de protection, comme cela a été montré chez la souris. Pathogène pour l'insecte dont il provoque assez souvent la mort, contrairement à T cruzi, T. rangeli peut être considéré comme un agent de régulation des populations de triatomes et, à ce titre, dans certaines régions, comme un agent de lutte microbiologique contre les vecteurs de la THAm. T. rangeli et T. cruzi ont pratiquement la moitié de leurs antigènes en commun. Toutes les réactions sérologiques utilisées dans le diagnostic de la maladie de Chagas peuvent croiser, y compris l'ELISA, technique que l'on avait pourtant cru capable de différencier les deux affections.
8 . 3 - Diagnostic de la THAm congénitale
Elle pose à peu de chose près les mêmes problèmes que celui de la toxoplasmose congénitale. Le parasite doit être recherché à la naissance dans le sang du cordon et les 3 ième et 30 ième jours au moins dans le sang de l’enfant. La sérologie ne peut être pratiqué que passé le 7 ième mois.
8/10