- Pré-requis et Objectifs
-
Cours
- Contenu
- Points essentiels
-
Version PDF

- Evaluations
- Annexes
Introduction
La trypanosomose humaine américaine, ou maladie de Chagas, transmise par des punaises, reste un problème de santé publique majeur pour dix-huit pays d’Amérique latine, malgré les importants progrès accomplis ces quinze dernières années en matière de lutte antivectorielle. Il s’agit d’une zoonose, avec un réservoir animal domestique et sauvage important. En 2009, sa prévalence était encore évaluée à 8 à 11 millions de cas (18 millions en 1990) et son incidence annuelle à 150 000 à 200 000 cas (500 000 à 700 000 en 1990). Elle reste prévalente dans le bassin amazonien, en Bolivie, a été retrouvée en Guyane française et est signalée aux États-Unis et en Europe chez des migrants. Elle est encore responsable de 14 000 décès par an.
L’existence de la THAm 7000 ans avant JC est attestée par la mise en évidence de fragments d’ADN de Trypanosoma cruzi dans des tissus de momies chinchorros retrouvées dans le nord du Chili et le sud du Pérou. La découverte de la maladie en tant qu’entité nosologique ne date par contre que de 1909 (C.Chagas). Liée à l’origine à l’extrême pauvreté de la paysannerie et à un certain type d’habitat rural favorable à la domiciliation et à la prolifération des vecteurs, la maladie de Chagas s’est progressivement urbanisée depuis une cinquantaine d’années et a changé de visage. Plus de 60% des chagasiques vivent aujourd’hui dans les villes où T. cruzi se transmet par voie transplacentaire, transfusion sanguine et dons d’organes.
1 - Le parasite
Trypanosoma cruzi, protozoaire flagellé, existe sous deux formes :
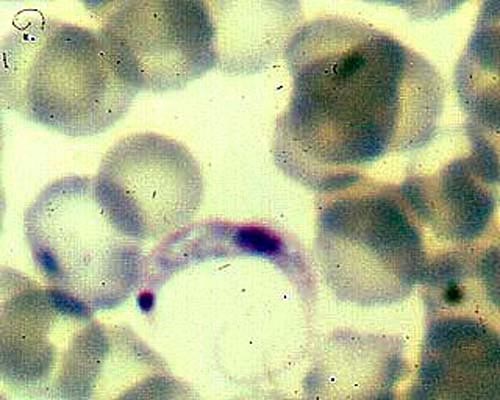
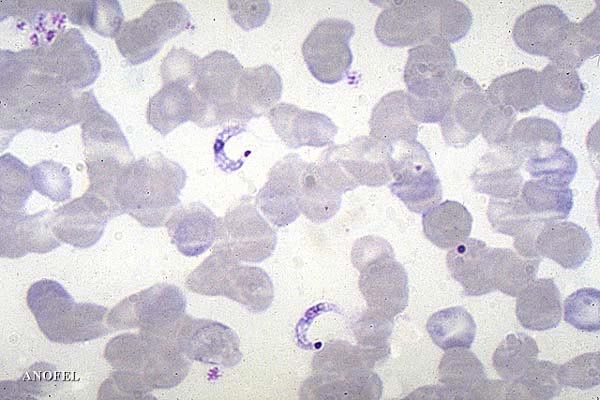
- dans le sang : forme extracellulaire, mobile (trypomastigote, 15 µm à 20 µm) ;
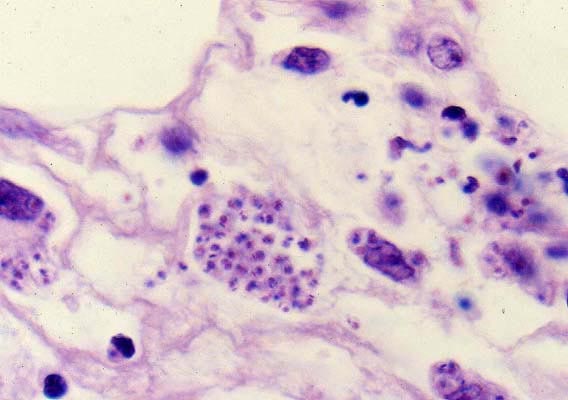
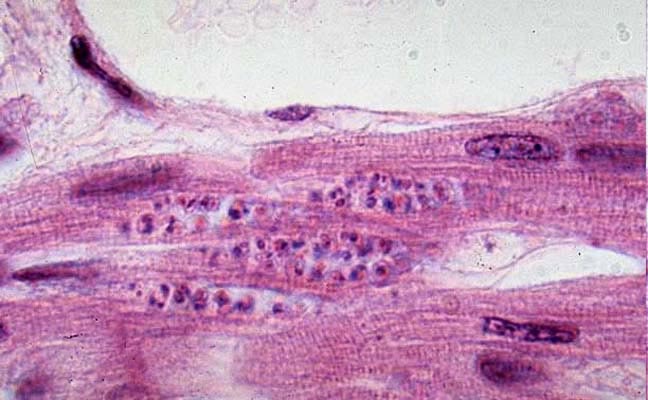
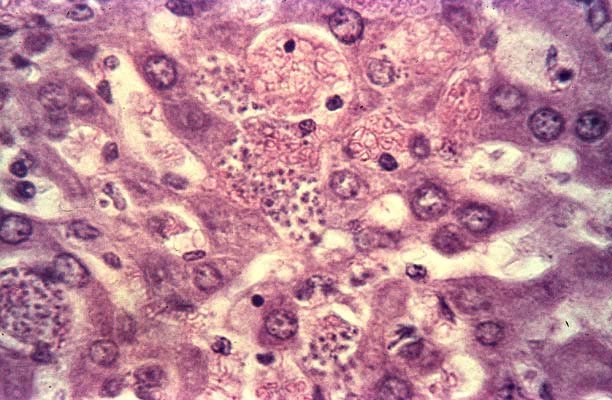
- dans les cellules : forme immobile, sans flagelle (amastigote, 2 µm à 3 µm).
Trypanosoma cruzi est assez facilement mis en évidence dans le sang sous forme trypomastigote pendant la phase aiguë. Il se différencie des trypanosomes du groupe brucei par la rareté de ses ondulations, un kinétoplaste subterminal très volumineux et l’absence de forme en division. Trypanosoma cruzi ne se multiplie en effet qu’à l’intérieure des cellules, sous forme amastigote. Le sous genre Schizotrypanum qu’il partage avec Trypanosoma dionisii, parasite des chauves-souris, a été crée pour rendre compte de ce phénomène.
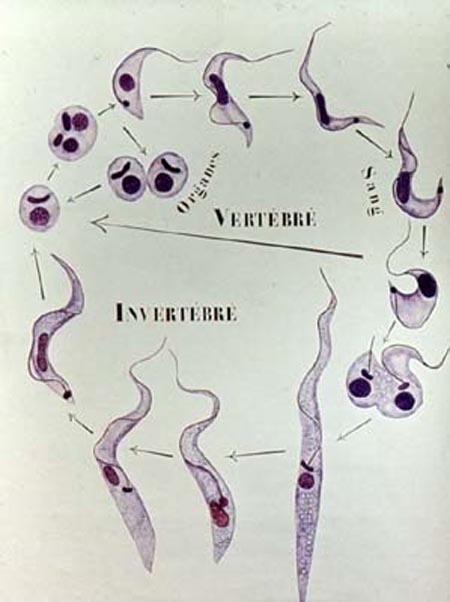
Figure 1: Cycle biologique de T. cruzi
T. cruzi est éliminé dans les déjections de son vecteur sous formes longues (trypanosomes métacycliques).
Il pénètre de manière active au travers des muqueuses saines (le plus souvent conjonctivales ou buccales) ou de la peau, à la faveur d’une minuscule solution de continuité (lésion de grattage, point de piqûre). Il se multiplie alors in situ dans les histiocytes sous forme amastigote. Il en ressort sous forme trypomastigote pour gagner, par voie sanguine, la plupart des organes : cœur, système réticulo-endothélial, plexus des systèmes nerveux autonomes, système nerveux central, dans les cellules desquels il pénètre à nouveau en se liant à différentes molécules, notamment la fibronectine. Certaines formes amastigotes sont capables d’infecter les cellules du voisinage sans repasser par la forme trypomastigote.
Le vecteur s’infecte en absorbant du sang contenant des formes trypomastigotes, très rares en phase chronique.
Celles-ci se multiplient dans l’intestin de l’insecte sous forme pro puis épimastigote avant de se transformer sous l’action de gènes spécifiques inductibles par l’AMP cyclique, en formes trypomastigotes longues infectantes au niveau du rectum (trypanosomes métacycliques) après environ 15 jours d’évolution.
1/10