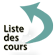8 . 2 . 2 - Techniques de référence
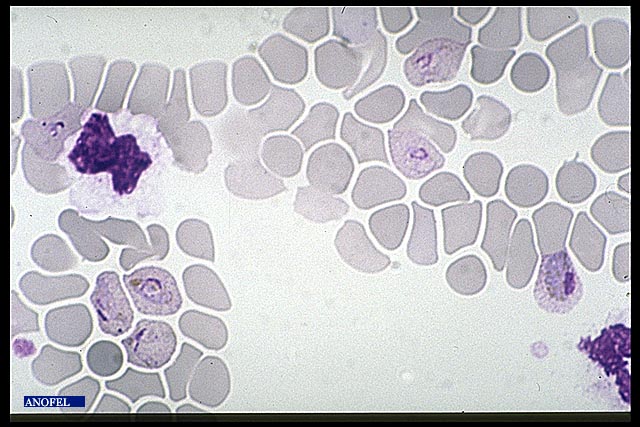
Goutte épaisse
Cette technique très ancienne réalise un microconcentration, et reste la méthode de référence. Elle consiste à examiner quelques µl de sang après hémolyse des globules rouges et coloration selon la méthode de Giemsa. C’est une excellente technique mais de réalisation un peu délicate et qui nécessite une bonne expérience pour la lecture. Le diagnostic d’espèce n’est pas toujours possible. Le nombre de parasites pour 200 leucocytes doit être compté.
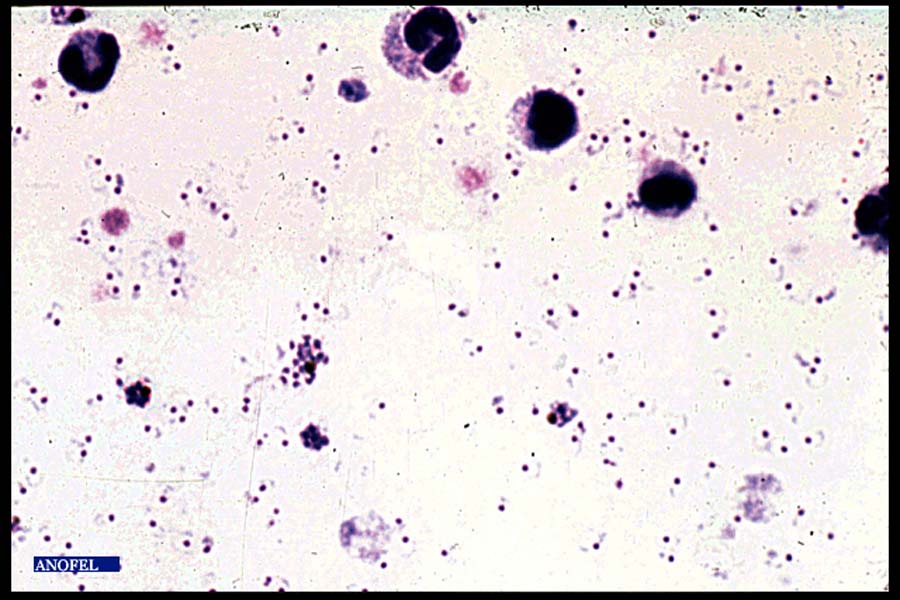
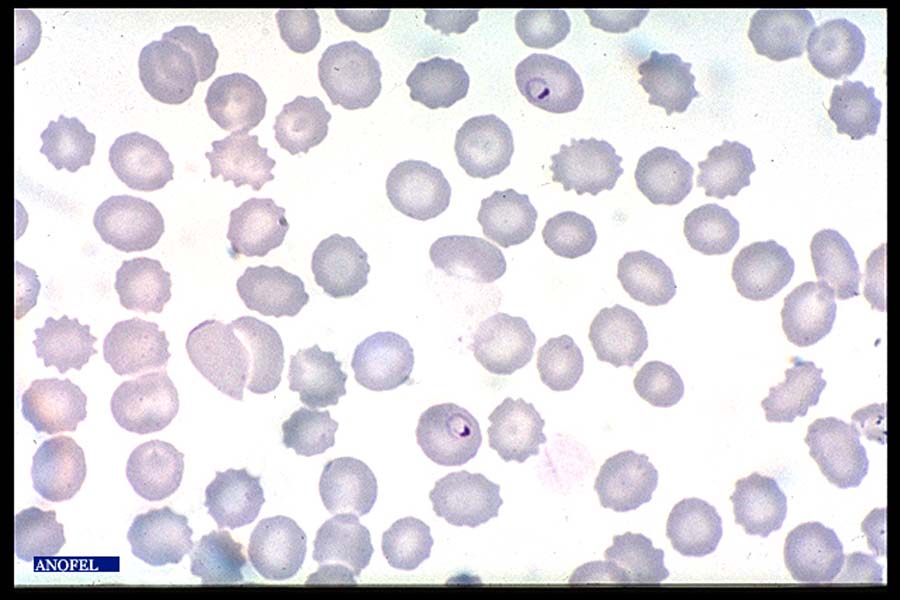
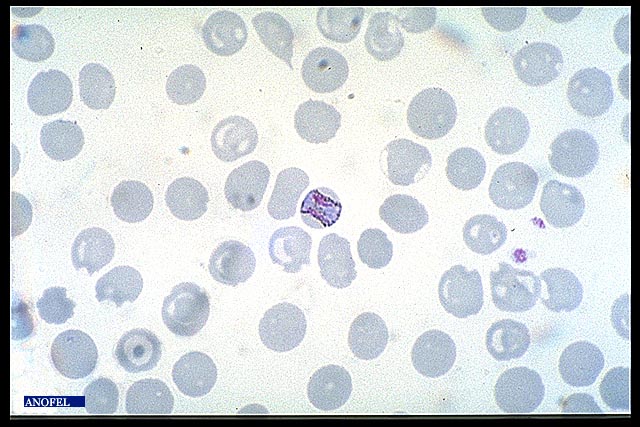
Frottis mince
La lame est colorée selon la méthode de May-Grünwald-Giemsa ou par du Giemsa après fixation à l’alcool. Les parasites, colorés en rouge (noyau) et bleu (cytoplasme) sont retrouvés à l’intérieur des globules rouges (pas d’hémolyse dans cette technique).
Le diagnostic positif et le diagnostic d’espèce s’en trouvent facilités.
Par contre la quantité de sang examinée est plus faible que sur une goutte épaisse et cette méthode peut être mise en défaut en cas de parasitémie faible (sensibilité théorique 20 à 30 fois moindre qu’avec la goutte épaisse).
Les recommandations de la conférence de consensus de 2007, demandent d’associer frottis mince et goutte épaisse.
8 . 2 . 3 - Autres techniques
Pour tenter de simplifier et d’améliorer le diagnostic biologique du paludisme, d’autres techniques ont été développées dont les tests rapides par immunochromatographie sur bandelette.
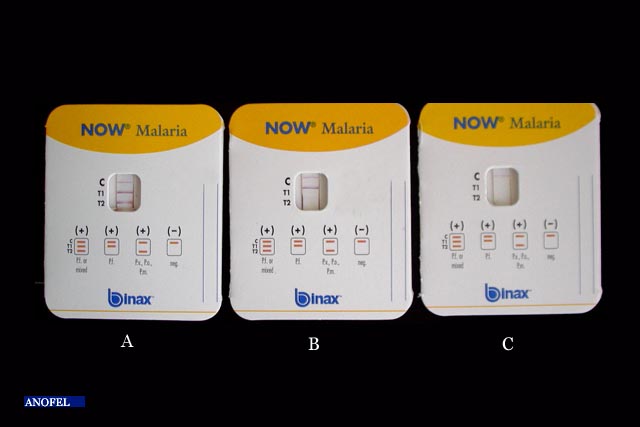
Tests de diagnostic rapide immunochromatographiques
Le principe de ces tests est la détection de protéines spécifiques de Plasmodium (antigènes HRP-2 ou enzymes pLDH, aldolase), en chromatographie sur un support solide. Certains de ces tests permettent maintenant d’affirmer un diagnostic positif (présence de Plasmodium) et d’orienter le diagnostic d’espèce : P. falciparum et/ou autre espèce. Ces tests rapides, très simples d’utilisation et conditionnés en emballages unitaires, sont très pratiques et ont une bonne sensibilité (surtout pour P. falciparum s’ils détectent l’antigène HRP-2) mais ne permettent pas de mesurer la parasitémie et restent positifs, pour certains, plusieurs jours après la disparition des plasmodies du sang. En France, ils doivent être considérés comme une aide au diagnostic mais ne doivent pas supplanter, à l’heure actuelle, les techniques microscopiques classiques basées sur la coloration d’une goutte épaisse et d’un frottis. L’intérêt de leur utilisation à large échelle en zone d’endémie est actuellement en discussion mais leur coût unitaire élevé reste un obstacle. L’utilisation de ces tests rapides dans les algorithmes de prise en charge du paludisme est recommandée lorsque l’examen microscopique n’est pas possible.
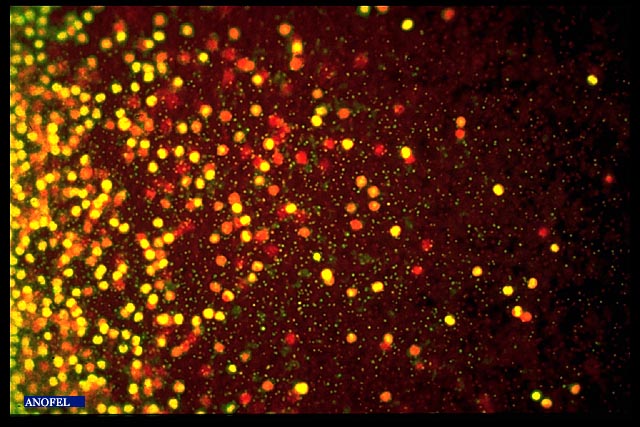
QBC Malaria® (Quantitative Buffy Coat)
Il s’agit d’une technique basée sur une centrifugation en tube capillaire et un marquage non spécifique des parasites par un fluorochrome (acridine orange). Il s’agit d’une technique de concentration, très facile à maîtriser, donnant une sensibilité équivalente à celle de la goutte épaisse (mais ne permettant pas un diagnostic d’espèce). En revanche elle nécessite un matériel spécifique. L’arrêt de sa commercialisation est annoncé.
Place de la biologie moléculaire
Des techniques de biologie moléculaire ont été développées pour le diagnostic du paludisme. Leur sensibilité est excellente et elles permettent un diagnostic d’espèce. Elles peuvent donc constituer une aide au diagnostic dans certains cas difficiles. Mais leur temps de réalisation et leur coût ne permettent pas, à l’heure actuelle, de les envisager en diagnostic de routine.
8 . 3 - Diagnostic biologique indirect
La sérologie n’est d’aucun apport pour le diagnostic d’urgence de l’accès palustre ; une sérologie positive signe uniquement un contact préalable avec le parasite.
Les indications de la sérologie sont :
– le diagnostic rétrospectif d’un accès palustre (par exemple, patient traité en zone d’endémie sans argument biologique de certitude) ;
– le diagnostic d’un paludisme viscéral évolutif ou d’une splénomégalie palustre hyperréactive ;
– le contrôle des donneurs de sang ou d’organes à risque ;
– les enquêtes épidémiologiques.