6 - Physiopathologie
La physiopathologie du paludisme est encore imparfaitement connue mais les répercussions de l’infection palustre sur certains organes ont été bien décrites.
Le sang
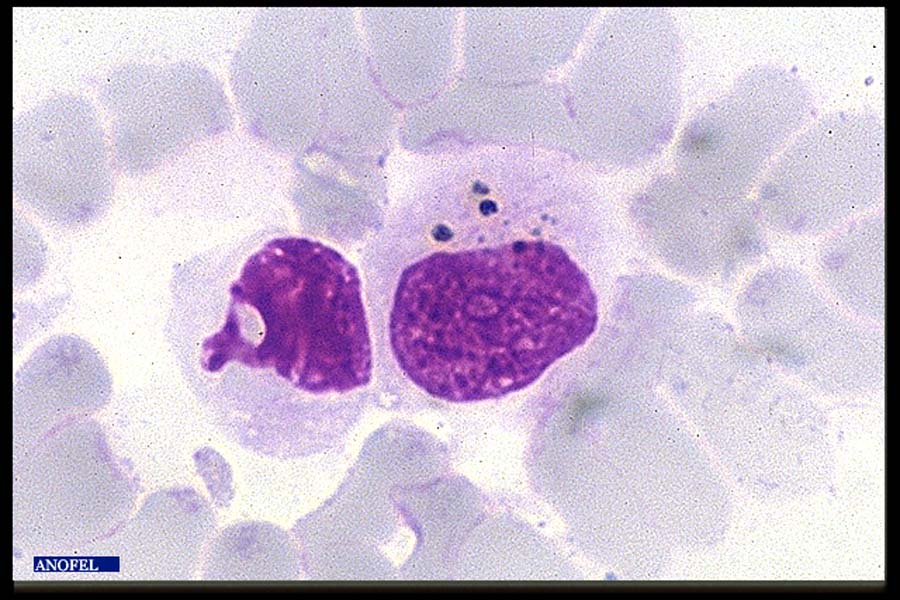
La phase de schizogonie érythrocytaire entraîne une hémolyse responsable d’une anémie d’installation progressive grave chez les jeunes enfants et les femmes enceintes. L’hémoglobine libérée par l’hémolyse provoque une surcharge rénale et est partiellement transformée en bilirubine dans le foie. L’excès est éliminé dans les urines entraînant une hémoglobinurie. D’autre part l’utilisation de l’hémoglobine par le parasite amène la précipitation dans son cytoplasme de granules de pigment (hémozoïne), dont la libération lors de l’éclatement du globule rouge est en partie responsable de la fièvre. Le pigment, accumulé dans le cytoplasme du schizonte, est relargué dans le plasma lors de la libération des mérozoïtes. Il est alors phagocyté par les monocytes-macrophages et les polynucléaires neutrophiles (leucocytes mélanifères).
Les plaquettes sont séquestrées par des mécanismes, encore mal précisés, probablement immunologiques. La conséquence en est une thrombopénie, perturbation biologique fréquemment et précocement observée au cours d’un accès palustre.
La rate
La rate est hypertrophique, molle et congestive. Sa couleur caractéristique, rouge foncé, parfois brune est due à l’accumulation du pigment internalisé par les phagocytes. L’augmentation de volume est provoquée par l’hypertrophie de la pulpe blanche (lymphocytes, cellules réticulaires, macrophages). L’activité phagocytaire concerne les globules rouges parasités, les débris cellulaires, le pigment parasitaire.
Histologiquement, au cours du paludisme viscéral évolutif, la rate est énorme, fibro-congestive et foncée à la coupe avec une hyperplasie lymphoïde et histiocytaire mais les parasites y sont rares.
Le foie
La schizogonie exo-érythrocytaire ne produit aucune lésion inflammatoire. La destruction par les schizontes d’un certain nombre de cellules parenchymateuses passe inaperçue. On observe une hyperplasie des cellules de Küpffer chargées de la phagocytose des débris cellulaires et de l’hémozoïne, associée à des dépôts d’hémosidérine. Ultérieurement les dépôts de pigment envahissent les espaces portes au sein d’infiltrats lympho-histiocytaires.
Physiopathologie de l'accès grave
Le neuropaludisme (accès pernicieux = « cerebral malaria » des anglo-saxons) et l’anémie, sont les complications majeures du paludisme à P. falciparum. Basées au départ sur des études anatomopathologiques post-mortem réalisées chez des patients décédés de neuropaludisme, de très nombreuses recherches ont été développées pour élucider sa physiopathologie. Plusieurs théories, probablement complémentaires sont actuellement retenues, notamment la séquestration d’hématies parasitées par des formes matures de Plasmodium, adhérant aux cellules endothéliales des micro-vaisseaux, et l’intervention de cytokines ou autres médiateurs.
Séquestration :
Les formes âgées de P. falciparum (trophozoïtes âgés, schizontes) disparaissent de la circulation sanguine périphérique et sont séquestrées dans les capillaires des organes profonds (cerveau mais aussi reins, poumons …). Cette séquestration est, au moins en partie, due à des phénomènes d’adhésion cellulaire (cytoadhérence) entre les globules rouges parasités et les cellules endothéliales de ces capillaires. Cette cytoadhérence est sous la dépendance d’interactions entre des récepteurs moléculaires présents à la surface des globules rouges parasités (PfEMP1) et des récepteurs spécifiques des cellules endothéliales (ICAM-1). Cette séquestration peut aussi être accentuée par des blocages dans les capillaires due à une déformabilité moindre des hématies parasitées, et à la formation de « rosettes » : agrégats constitués d’une hématie parasitée à laquelle adhèrent plusieurs hématies non parasitées
Cytokines et autres médiateurs :
Des cytokines pro-inflammatoires (TNF-a, IFN-g, IL1, IL6...) et différents produits métaboliques (NO, acide lactique …) sont produits, en cascade, au cours du neuropaludisme. Leur action se conjugue probablement au phénomène de blocage circulatoire conséquence de la séquestration. Les modèles expérimentaux étant forcément réducteurs, il est difficile de savoir comment s’articulent, in vivo, ces différents mécanismes. Ce qui a été décrit au niveau du cerveau est probablement vrai au niveau des autres organes (reins, poumon, placenta…) expliquant la défaillance multiviscérale parfois observée lors d’un accès grave. Il apparaît évident maintenant que la physiopathologie du paludisme grave est probablement beaucoup plus complexe qu’on a pu le penser initialement.