- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Physiopathologie
-
2 - Angine de poitrine (angor) stable
- 2.1 - Physiopathologie, généralités
-
2.2 - Diagnostic
- 2 . 2 . 1 - Signes fonctionnels
- 2 . 2 . 2 - Examen clinique
-
2
.
2
.
3 - Examens paracliniques
- 2 . 2 . 3 . 1 - Électrocardiogramme
- 2 . 2 . 3 . 2 - Électrocardiogramme d’effort (figure 2)
- 2 . 2 . 3 . 3 - Scintigraphie myocardique de perfusion d’effort ou équivalent (figure 3)
- 2 . 2 . 3 . 4 - Échocardiographie d’effort ou après dobutamine
- 2 . 2 . 3 . 5 - Coronarographie (figure 4)
- 2 . 2 . 3 . 6 - Scannographie
- 2.3 - Pronostic
- 2.4 - Traitement
- 3 - Définition des syndromes coronaires (figure 5)
-
4 - Syndromes coronaires sans sus-décalage de ST
- 4.1 - Généralités
- 4.2 - Diagnostic d’un SCA non ST
- 4.3 - Diagnostic différentiel
- 4.4 - Pronostic du SCA sans sus-décalage persistant de ST
- 4.5 - Traitement
-
5 - Syndromes coronaires avec sus-décalage de ST
- 5.1 - Généralités
- 5.2 - Diagnostic
- 5.3 - Diagnostic différentiel
- 5.4 - Complications
- 5.5 - Traitement du SCA avec sus-décalage de ST non compliqué
-
5.6 - Traitement des complications du SCA avec sus-décalage de ST
- 5 . 6 . 1 - Troubles du rythme ventriculaire précoces
- 5 . 6 . 2 - Troubles du rythme ventriculaire tardifs
- 5 . 6 . 3 - Troubles du rythme supraventriculaire (précoces)
- 5 . 6 . 4 - Bradycardie sinusale et troubles de la conduction
- 5 . 6 . 5 - Insuffisance cardiaque et choc cardiogénique
- 5 . 6 . 6 - Complications mécaniques
-
6 - Examens paracliniques de la maladie coronaire
-
6.1 - Examens permettant d’identifier l’ischémie myocardique
- 6 . 1 . 1 - Électrocardiogramme per- et post-critique (ECG)
- 6 . 1 . 2 - Électrocardiogramme d’effort (cf figure 2)
- 6 . 1 . 3 - Scintigraphie myocardique de perfusion d’effort ou équivalent (cf figure 3)
- 6 . 1 . 4 - Échocardiographie d’effort ou sous dobutamine
- 6 . 1 . 5 - Mesure de la réserve coronaire
- 6.2 - Coronarographie (cf figure 4)
-
6.1 - Examens permettant d’identifier l’ischémie myocardique
- 7 - Points clés
- 8 - Pour en savoir plus
-
Version PDF

-
Contenu
- Evaluations
- Annexes
5 - Syndromes coronaires avec sus-décalage de ST
5 . 1 - Généralités
5 . 1 . 1 - Nosologie
L’infarctus du myocarde (IDM) est défini comme une nécrose myocardique d’origine ischémique.
Les progrès de la biologie permettent le diagnostic d’une nécrose myocardique de moins de 1 g qui induit une élévation des troponines.
Le diagnostic de l’ischémie myocardique aiguë est électroclinique. Elle induit une douleur thoracique (angor) et des modifications électrocardiographiques. L’association des deux symptômes permet de poser le diagnostic de syndrome coronaire aigu (SCA).
La mise en évidence d’une troponinémie dans les suites d’un SCA permet de poser le diagnostic d’IDM.
Ne pas confondre la douleur angineuse associée à des modifications électrocardiographiques transitoires, régressives après prise de trinitrine sublinguale avec la douleur angineuse associée à un sus-décalage du segment ST résistant à la prise de trinitrine (SCA ST+) : elle traduit l’occlusion soudaine d’une artère coronaire et, en l’absence de traitement, induit des dégâts myocardiques majeurs.
5 . 1 . 2 - Physiopathologie
5 . 1 . 2 . 1 - Accident vasculaire coronaire athérothrombotique
La rupture, fissuration ou ulcération d’une plaque athéromateuse vulnérable induit une réaction thrombotique locale et une vasoconstriction artérielle transitoire.
Le trombus est initialement plaquettaire non occlusif et secondairement se transforme et devient fibrino-cruorique, plus volumineux et occlusif.
Le thrombus est instable. Il peut se fragmenter, migrer en distalité et occlure des vaisseaux de plus petit calibre ou des capillaires, ou à l’inverse s’étendre en amont ou en aval de la lésion causale.
5 . 1 . 2 . 2 - OCA responsable d’une anoxie myocardique
Le segment myocardique concerné n’est pas d’emblée totalement détruit. La nécrose myocardique s’étend progressivement tel un « front de vague » à l’ensemble du myocarde concerné.
Le délai de constitution de la nécrose est influencé par son volume et l’existence de mécanismes de défense. L’évolution peut être ralentie si le myocarde à risque est alimenté par une circulation collatérale (communication entre l’artère occluse et une artère saine) ou s’il est « pré-conditionné » (le pré-conditionnement – tolérance de l’ischémie – est observé lorsque l’occlusion est précédée de phénomènes subocclusifs répétés). Dans tous les cas, le délai reste < ou = 12 heures.
L’ischémie aiguë se traduit par une akinésie du segment concerné et, en réaction, une hyperkinésie transitoire des segments controlatéraux. L’akinésie est en partie réversible (phénomène de sidération pouvant persister plusieurs semaines) si le myocarde est rapidement reperfusé.
En l’absence de reperfusion, la nécrose survient. L’hyperkinésie réactionnelle s’atténue et une dilatation du ventricule gauche peut apparaître (remodelage), responsable d’une insuffisance cardiaque chronique (manifestation clinique de la dysfonction ventriculaire gauche) en règle associée à un risque de survenue de troubles du rythme ventriculaire sévères. L’akinésie peut évoluer vers la dyskinésie (contraction paradoxale) et la formation d’un anévrysme ventriculaire gauche.
L’existence de lésions pré-existantes controlatérales à l’OCA limite les possibilités d’hyperkinésie compensatoire et favorise l’installation rapide d’une insuffisance cardiaque, voire d’un choc cardiogénique.
5 . 1 . 3 - Traitement
Le diagnostic du SCA ST + est en règle facile. L’objectif du traitement est de désobstruer le plus rapidement possible l’artère occluse pour limiter l’étendue de la nécrose myocardique et prévenir la survenue secondaire d’une insuffisance cardiaque.
5 . 2 - Diagnostic
5 . 2 . 1 - Forme typique IDM avec ST non compliquée
L’IDM peut être inaugural ou survenir chez un patient présentant des antécédents coronaires.
Il est souvent précédé de crises angineuses récurrentes (angor instable, SCA non ST).
À la phase initiale (< 12 h), le diagnostic repose avant tout sur l’association de signes cliniques et ECG (SCA ST). Il doit être posé rapidement et justifie la mise en œuvre immédiate d’une stratégie de reperfusion.
La douleur précordiale est le maître symptôme, elle est typiquement angineuse, rétrosternale (débute au niveau de la partie médiane ou gauche du précordium) en barre, constrictive, très violente, irradiant dans les avant-bras ou les poignets, les mâchoires, le dos ou les épaules. Elle survient au repos (ou en récupération après effort). Elle est prolongée (> 30 min) et trinitro-résistante. Elle est souvent violente, accompagnée de signes neurovégétatifs ou d’accompagnement : sueurs, éructations, nausées, vomissements.
La douleur peut être atypique : simple brûlure rétrosternale, douleur localisée à l’épigastre (IDM inférieur), aux bras, épaules, poignets, mâchoires, dos sans être associée à une douleur précordiale. Cependant, la douleur n’est influencée ni par la mobilisation des muscles de la région douloureuse, ni par la respiration profonde et elle n’est pas provoquée par une mauvaise position.
L’examen clinique est en général normal mais l’auscultation cardiaque peut mettre en évidence un bruit de galop.
L’ECG met en évidence un sus-décalage du segment ST de plus de 1 mm en dérivations frontales (DI – Vl, DII – DIII – Vf) et 2 mm en dérivations précordiales (V1 – V6), au niveau d’au moins deux dérivations contiguës (même plan).
Le sus-décalage, associé à une douleur précordiale évoluant depuis moins de 12 heures et trinitro-résistante, permet de porter avec quasi-certitude le diagnostic d’OCA et impose la mise en œuvre d’une stratégie de reperfusion.
Le sus-décalage du segment ST (onde de Pardee) débute au point J, englobe l’onde T. Il est convexe vers le haut et siège en regard du territoire ischémique (signe direct). Il apparaît dans les premières minutes suivant l’OCA, précédé d’une amplification de l’onde T (stade hyper-précoce). Il permet de définir la topographie de l’ischémie myocardique : antérieure (antéroseptale : V1, V2, V3 ; antérieure étendue : V1 à V6, DI, Vl) ; latérale (haute : DI, Vl ; basse : V5, V6) ; inférieure : DII, DIII, Vf ; basale (postérieure) : V7, V8, V9.
Il peut être masqué par un bloc de branche gauche (BBG) lorsqu’il intéresse les dérivations V1 – V3. Un BBG récent a valeur de sus-décalage (intérêt d’un ECG ancien) lorsqu’il est associé à une symptomatologie typique. Le bloc de branche droite (BBD) n’interfère pas dans le diagnostic d’IDM.
Le sous-décalage en miroir du segment ST est un signe indirect inconstant, observé dans les dérivations antérieures lorsque le sus-décalage est inférieur ou postérieur. Sa mise en évidence chez un patient présentant un angor spontané trinitro-résistant justifie la recherche de signes directs dans les dérivations standard et postérieures (V7, V8, V9).
5 . 2 . 2 - Évolution
5 . 2 . 2 . 1 - Clinique
La mise en évidence d’un SCA ST justifie la mise en œuvre immédiate d’une stratégie de reperfusion par thrombolyse intraveineuse ou par ICP.
La reperfusion myocardique s’accompagne d’une régression rapide de la douleur angineuse et du sus-décalage du segment ST (< 60 min) qui revient à la ligne iso-électrique, suivie par la négativation des ondes T qui peuvent être à nouveau positives ultérieurement. Une onde Q peut se constituer (sans valeur pronostique).
En l’absence de reperfusion, l’évolution est identique mais plus lente et l’onde Q est plus fréquente.
Dans tous les cas, une fébricule voisine de 38 °C est présente à la 6e–8e heure et persiste durant 24–48 heures, traduisant une réaction non spécifique de l’organisme à la nécrose.
L’onde Q de nécrose est un signe direct de nécrose constituée lorsqu’elle est supérieure à 0,04 s et profonde (> ou = 1 mm). Elle apparaît dans un délai variable mais en moyenne à la 6e–12e heure. Le plus souvent elle persiste indéfiniment (séquelle d’IDM). Elle n’est pas systématique et ne traduit pas toujours une nécrose étendue (l’étendue de la nécrose est beaucoup mieux évaluée par échocardiographie). Sa topographie est celle du sus-décalage qui l’a précédée. Elle permet de définir a posteriori le territoire de la nécrose.
Le BBG masque habituellement les ondes Q.
5 . 2 . 2 . 2 - Marqueurs de la nécrose, troponines et marqueurs « historiques »
La nécrose myocardique libère des marqueurs dont la plupart peuvent provenir d’autres organes (muscle squelettique en particulier). Seules les troponines (T-I) sont spécifiques du tissu myocardique.
Le dosage des enzymes peu spécifiques suivant n’est plus recommandé :
- la myoglobine est le marqueur le plus précoce. Le début de l’élévation a lieu dans les 2–3 h qui suivent l’OCA ;
- créatinine kinase (CK) : l’élévation est observée à la 6e heure. Le pic se situe vers la 36e heure. Les CK reviennent à la normale au 3e–4e jour. L’isoforme CK-MB est spécifique du myocarde ;
- transaminases SGOT ou SGPT ne sont plus dosées.
- lactate déshydrogénase (LDH) : le taux s’élève à la 24e heure.
Le marqueur le plus fiable est la troponine. Très sensible, il permet la détection d’une nécrose < 1 g. La troponinémie est élevée dès la 4e heure et peut le rester au-delà du 10e jour suivant l’épisode ischémique. L’augmentation est définie par rapport à une valeur de référence spécifique de la méthode de dosage (plusieurs méthodes sont disponibles).
Le diagnostic de nécrose myocardique est confirmé lorsque les taux sanguins de la troponine ou à défaut des CK-MB sont élevés (confirmation par deux dosages consécutifs) dans les suites d’un épisode ischémique. Un prélèvement sanguin doit être obtenu à l’admission, à 6–9 heures et à 12–24 heures.
Lorsqu’un diagnostic très précoce doit être obtenu (tableau électroclinique atypique), il est recommandé de réaliser un dosage immédiat d’un marqueur peu spécifique mais qui s’élève rapidement (myoglobine) et de confirmer par un dosage ultérieur de la troponine.
Le niveau atteint par les marqueurs spécifiques est classiquement corrélé au pronostic de l’IDM. Cette notion ne s’applique pas si une reperfusion très précoce est obtenue (pic enzymatique précoce).
Le diagnostic d’une récidive d’IDM repose sur la mise en évidence d’une réascension des CK-MB (normalisation précoce =/= troponine) dans les suites d’une récidive angineuse.
L’IDM est à l’origine d’un syndrome inflammatoire qui se traduit par augmentation de la vitesse de sédimentation (à partir du 2e–3e jour) de la fibrinogénémie, une hyperleucocytose à polynucléaires neutrophiles (par démargination), maximale au 2e–3e jour, persistant pendant environ une semaine et parfois au-delà.
L’évaluation des facteurs de risque biologique (bilan lipidique, glycémie) tient compte des conditions de prélèvement. Le taux du cholestérol total est abaissé durant plusieurs mois et la glycémie peut être élevée transitoirement à l’admission justifiant, en l’absence de diabète connu, un contrôle à distance (3 mois).
5 . 2 . 2 . 3 - Évolution hospitalière secondaire
En l’absence de complication, le patient peut s’asseoir au bord du lit dès la 12e heure suivant son admission en unité de soins intensifs coronaires (USIC) et déjeuner par ses propres moyens.
La marche à plat est autorisée dès le 2e jour (200 m) et la marche en côte les jours suivants.
La sortie de l’hôpital peut être envisagée dès le 5e jour, éventuellement pour un centre de réadaptation à l’effort.
L’arrêt de toute activité professionnelle est proposée pour 1 mois. Un certificat de demande de prise en charge des soins à 100 % est remis.
5 . 2 . 3 - Formes cliniques
5 . 2 . 3 . 1 - Forme indolore
Elles sont fréquentes.
La douleur peut manquer (surtout chez les sujets diabétiques). L’IDM est alors découvert tardivement (onde Q « nouvelle ») ou révélé par une complication (trouble du rythme, œdème aigu pulmonaire, accident embolique).
5 . 2 . 3 . 2 - Angor spontané nitro-résistant sans sus-décalage de ST
La description d’une douleur angineuse prolongée nitro-résistante fait évoquer une OCA et justifie la recherche d’un sus-décalage du segment ST dans des dérivations complémentaires (postérieures V7, V8, V9).
En l’absence de sus-décalage, l’échocardiographie per-critique au lit du malade permet d’exclure le diagnostic d’IDM étendu lorsqu’elle n’identifie pas une anomalie de la cinétique segmentaire du ventricule gauche. En effet, ces anomalies apparaissent dans les secondes qui suivent l’occlusion coronaire, bien avant la constitution de la nécrose. Cependant elles peuvent aussi traduire une séquelle d’un IDM ancien.
L’échocardiographie est surtout pratiquée pour identifier une autre origine à la douleur comme une dissection aortique aiguë, un épanchement péricardique ou une embolie pulmonaire massive.
La coronarographie à visée diagnostique est utile chaque fois que le diagnostic électroclinique n’est pas typique (ex. : BBG ancien).
5 . 2 . 3 . 3 - IDM non ST
La prise en charge de cette entité est indiquée au chapitre 4.1.1. La constatation secondaire d’une élévation de la troponinémie permet de poser le diagnostic d’infarctus non ST sans modifier le principe général de la stratégie thérapeutique.
5 . 3 - Diagnostic différentiel
5 . 3 . 1 - Péricardite aiguë
Le diagnostic peut être difficile dans les premières heures de l’évolution. La douleur thoracique est modifiée par la position, exagérée par le décubitus, calmée par la position assise, exacerbée par les mouvements inspiratoires.
L’ECG met en évidence un sus-décalage du segment ST cependant diffus, observé dans pratiquement toutes les dérivations et souvent associé à un sous-décalage du segment PQ.
La notion d’un épisode infectieux ORL récent oriente vers une origine virale.
5 . 3 . 2 - Embolie pulmonaire
Elle peut être responsable de douleurs thoraciques et d’une chute de la tension artérielle, voire de l’apparition de signes de choc.
L’ECG ne montre pas de sus-décalage de ST (aspect classique S1Q3).
Le contexte favorisant et la mise en évidence d’une hypoxémie et d’une hypocapnie par la gazométrie redressent le diagnostic.
5 . 3 . 3 - Dissection aortique
Le diagnostic peut être très difficile car le terrain est habituellement commun. La douleur thoracique est migratrice. L’examen met en évidence une asymétrie tensionnelle.
L’ECG ne montre pas de sus-décalage de ST.
5 . 3 . 4 - Pathologie sous-diaphragmatique
Les urgences abdominales suivantes doivent être évoquées :
- cholécystite aiguë ;
- ulcère perforé ;
- surtout pancréatite aiguë hémorragique pouvant parfois prêter à confusion avec une nécrose myocardique.
5 . 4 - Complications
5 . 4 . 1 - Complications hospitalières précoces
5 . 4 . 1 . 1 - Troubles du rythme et de la conduction
Les troubles du rythme ventriculaire sont extrêmement fréquents à la phase initiale d’un SCA ST +, indépendants de l’étendue de la zone ischémique. Ils sont responsables des morts subites pré-hospitalières mais n’ont pas d’impact sur le pronostic ultérieur. Ils justifient une prise en charge médicalisée (SMUR) dès le diagnostic évoqué (en pratique appel du médecin régulateur du 15) et le transfert en USIC (indirect après admission en salle de cathétérisme si une ICP primaire est proposée).
Les troubles du rythme supraventriculaire comportent la fibrillation atriale (et autres troubles du rythme supraventriculaire) et peuvent être à l’origine d’une décompensation hémodynamique ou responsables d’accidents emboliques. L’ischémie aiguë contre-indique l’utilisation des digitaliques.
Parmi les bradycardies et troubles de la conduction, le plus grave est le bloc auriculoventriculaire (BAV). Il est souvent transitoire (nodal) dans l’IDM inférieur. À l’inverse, le BAV définitif (infra-nodal, hissien) témoigne de dégâts ventriculaires majeurs et irréversibles dans l’IDM antérieur. Il est en règle mal toléré.
L’hypervagotonie (bradycardie, hypotension artérielle) est fréquente dans l’IDM inférieur et répond à l’atropine et au remplissage macromoléculaire.
5 . 4 . 1 . 2 - Insuffisance cardiaque
L’IC est un facteur de mauvais pronostic à court et moyen terme. Elle peut être la conséquence directe de l’étendue de la nécrose, d’une complication mécanique (insuffisance mitrale ischémique, communication interventriculaire) ou être favorisée par la survenue d’une arythmie.
Elle justifie une évaluation échocardiographique précoce. L’altération symptomatique ou marquée (FEVG < 50 %) de la fonction ventriculaire gauche justifie l’alitement du patient durant les 24 premières heures, délai d’apparition des complications.
La sévérité de l’IVG est définie par la classification de Killip (cf. item 250).
5 . 4 . 1 . 3 - Choc cardiogénique
Le choc cardiogénique (CC) complique 6 à 7 % des IDM.
Au stade constitué, il associe hypotension et signes d’hypoperfusion périphérique (extrémités froides, oligurie, confusion).
Il est défini par une pression artérielle systolique (PAS) < 90 mmHg, une pression capillaire > 20 mmHg ou un index cardiaque (IC : débit cardiaque mesuré par cathétérisme droit à l’aide d’une sonde de Swan-Ganz, rapporté à la surface corporelle) < 1,8 L/min/m2.
Le diagnostic est aussi établi si un support inotrope ou la mise en place d’une assistance par contre-pulsion par ballon intra-aortique (CPBIA) sont nécessaires pour maintenir une PAS > 90 mmHg et un IC > 1,8 L/min/m2.
Au stade initial, le diagnostic est posé en l’absence de cathétérisme droit sur la seule notion d’une hypotension artérielle mal tolérée, ne répondant pas au remplissage macromoléculaire ce qui élimine une hypovolémie, et après avoir corrigé une éventuelle bradycardie d’origine vagale (tachycardie habituelle dans le CC) ou une arythmie.
Le CC traduit habituellement une nécrose étendue du VG mais peut compliquer une atteinte du VD ou être la conséquence d’une complication mécanique qui est évaluée par échocardiographie. Il est rarement inaugural. Plus souvent, il survient secondairement dans les 24 à 48 heures suivant l’OCA, soit à l’occasion d’une récidive ischémique, soit précédé d’une détérioration hémodynamique progressive (« état de pré-choc »).
La coronarographie retrouve le plus souvent une occlusion proximale de l’interventriculaire antérieure et/ou des lésions pluritronculaires.
Le pronostic hospitalier est très sombre avec une mortalité > 70 %. Il peut être amélioré par une revascularisation rapide associée à la mise en place d’une assistance circulatoire temporaire.
5 . 4 . 1 . 4 - Complications mécaniques
La rupture aiguë de la paroi libre du VGL est responsable d’un collapsus avec dissociation électromécanique (activité électrique mais absence de contraction du VG et de pouls), rapidement fatal.
La rupture subaiguë se traduit par une récidive douloureuse pseudo-angineuse, avec élévation du segment ST, ou par une hypotension artérielle brutale et prolongée. Les signes de tamponnade apparaissent rapidement, souvent associés à des vomissements et le diagnostic est confirmé par échocardiographie (hémopéricarde) justifiant un geste chirurgical immédiat.
La rupture septale n’est pas rare (1–2 %). Le diagnostic, évoqué devant une complication hémodynamique, est confirmé par la mise en évidence d’un souffle précordial systolique (parfois absent) et surtout par l’échocardiographie avec doppler couleur. Le cathétérisme droit avec oxymétrie réalisé à l’occasion de la coronarographie préopératoire identifie un saut oxymétrique au niveau du ventricule droit (la saturation en oxygène est plus élevée dans l’artère pulmonaire que dans l’oreillette droite). Malgré la fermeture chirurgicale rapide de la communication, la mortalité hospitalière reste élevée (25–60 %).
Trois mécanismes peuvent être à l’origine d’une insuffisance mitrale : dysfonction d’un pilier mitral (infarctus inférieur), rupture d’un pilier mitral (IM aiguë) ou dilatation de l’anneau mitral secondaire à la dilatation du VG (IM tardive). La rupture de pilier (muscle papillaire) induit une défaillance cardiaque brutale et l’apparition d’un souffle systolique souvent discret. Le diagnostic est porté par l’échocardiographie. Le traitement est chirurgical (remplacement valvulaire) souvent précédé de la mise en place d’une assistance circulatoire par CPBIA.
5 . 4 . 1 . 5 - Infarctus du ventricule droit
Il peut prendre le masque d’un CC mais son traitement est très différent. La triade symptomatique classique associe, chez un patient présentant un IDM inférieur : hypotension artérielle + champs pulmonaires clairs + turgescence jugulaire.
L’ECG peut identifier un sus-décalage du segment ST en V1, V3R et V4R.
L’échocardiographie met en évidence une dilatation et une hypokinésie du ventricule droit (VD), une dilatation de l’oreillette droite et une insuffisance tricuspide par dilatation de l’anneau.
L’infarctus du VD est souvent compliqué d’une fibrillation atriale qui compromet l’hémodynamique et doit être rapidement réduite.
L’extension au VD contre-indique l’administration de vasodilatateurs et limite les possibilités d’utilisation d’un β-bloqueur.
5 . 4 . 2 - Complications hospitalières tardives
5 . 4 . 2 . 1 - Complications hospitalières tardives
Cette complication est actuellement peu fréquente et survient chez les patients dont l’état justifie un alitement prolongé.
5 . 4 . 2 . 2 - Thrombus intra-VG et embolie systémique
Le thrombus est dépisté par l’échocardiographie dont la réalisation doit être précoce, en particulier si la nécrose est étendue.
Il est plus volontiers retrouvé après un IDM antérieur.
Il justifie un traitement anticoagulant.
La complication embolique la plus grave est cérébrale, l’ischémie étant compliquée d’une hémorragie souvent fatale, favorisée par le traitement anticoagulant. L’embolie peut être favorisée par une fibrillation atriale.
5 . 4 . 2 . 3 - Péricardite
Le mécanisme de la péricardite compliquant l’IDM étendu peut être hémodynamique, mais un syndrome inflammatoire est habituel et son intensité croît avec l’étendue de la nécrose, justifiant le traitement par aspirine à forte dose (3 g/j) ou anti-inflammatoires non stéroïdiens dans les formes très algiques.
Les péricardites précoces sont très fréquentes, souvent asymptomatiques, parfois se traduisant par une douleur thoracique (classiquement influencée par le changement de position, aggravée par le décubitus, calmée par la position assise) se limitant en général à un frottement péricardique et à un décollement péricardique à l’échographie.
Les péricardites secondaires surviennent à la troisième semaine, réalisant le syndrome de Dressler. Le tableau de péricardite peut s’accompagner d’un épanchement pleural, d’arthralgies, d’une reprise thermique. Le syndrome inflammatoire est en général important. L’évolution est en règle favorable sous traitement. Le niveau de l’anticoagulation doit être réduit.
5 . 4 . 2 . 4 - Troubles du rythme ventriculaire tardifs
Les troubles du rythme ventriculaire sévères, tachycardie ou fibrillation ventriculaires, de survenue tardive (> 1 semaine) sont d’autant plus fréquents que la nécrose myocardique est étendue.
Ils peuvent être favorisés par une ischémie myocardique résiduelle.
5 . 4 . 2 . 5 - Angor et ischémie post-infarctus
La récidive ischémique peut être secondaire à la réocclusion de l’artère désobstruée, ou traduire l’existence d’une sténose résiduelle ou de lésions controlatérales souvent préalablement asymptomatiques.
Elle s’exprime sous la forme d’une récidive d’IDM (responsable d’une nouvelle élévation des CK-MB) ou de crise angineuse spontanée. Un angor d’effort peut être constaté lors de la reprise d’une activité. Une ischémie (douloureuse ou silencieuse) peut être induite lors d’une épreuve d’effort.
L’épreuve d’effort peut être pratiquée dès le 5e jour d’hospitalisation en l’absence de contre-indication. Elle est justifiée après fibrinolyse intraveineuse ou en l’absence de reperfusion. Elle est indiquée après revascularisation initiale par intervention coronaire percutanée (ICP) pour évaluer le retentissement de lésions controlatérales détectées par la coronarographie initiale.
La mise en évidence d’une ischémie au décours d’un IDM justifie la réalisation d’une revascularisation.
5 . 4 . 2 . 6 - Dysfonction ventriculaire gauche
La persistance d’une altération de la fonction ventriculaire gauche au décours d’un IDM peut avoir plusieurs causes :
- lésions définitives du tissu myocardique, nécrose puis fibrose ;
- anomalie fonctionnelle transitoire répondant par sidération myocardique post-ischémique réversible dans les 2 semaines qui suivent l’épisode ischémique (après reperfusion précoce) ;
- anomalie fonctionnelle transitoire par hibernation myocardique secondaire à une hypoperfusion myocardique chronique (sténose coronaire sévère résiduelle après reperfusion).
En pratique, ces différents mécanismes sont souvent intriqués et, face à une altération de la contractilité ventriculaire, la part des territoires nécrosés et viables doit être faite.
Le bilan repose sur la réalisation de tests fonctionnels : scintigraphie myocardique de perfusion avec redistribution tardive (le myocarde viable fixe le traceur), échocardiographie de stress à la dobutamine (le myocarde viable stimulé récupère une contractilité).
Après revascularisation (indiquée si sténose sévère et myocarde viable), la fonction VG doit être réévaluée (échocardiographie).
L’altération persistante est un facteur de risque de décompensation et de survenue tardive de troubles du rythme ventriculaire.
L’évolution naturelle d’une altération marquée de la cinétique segmentaire du VG est souvent péjorative : dilatation globale par remodelage, formation d’une zone anévrysmale (évolution prédite dès les premiers jours).
L’anévrysme du ventricule gauche, déformation du VG en systole (dyskinésie) et en diastole, se comporte d’un point de vue hémodynamique comme une double valvulopathie régurgitante mitrale et aortique : en systole la cavité anévrysmale se remplit, en diastole elle se vidange dans le ventricule gauche. Le traitement peut être chirurgical, la résection de l’anévrysme étant envisagée si la cavité ventriculaire restante est suffisante.
5 . 4 . 3 - Évaluation précoce du pronostic de l’IDM
Ce pronostic peut être déclinés en trois niveaux de risque différents :
- les patients à haut risque de complications secondaires peuvent être identifiés en raison d’un(e) :
- hypotension artérielle persistante,
- insuffisance ventriculaire gauche non stabilisée,
- arythmie ventriculaire grave (TV),
- angor spontané ou au moindre effort,
- FEVG < 35 %,
- ischémie (scintigraphie) ? 50 % du myocarde ;
- patients à bas risque :
- asymptomatiques,
- et FEVG > 50 %,
- et territoire ischémique < 20 % ;
- population à risque intermédiaire : par exemple, angor d’effort secondaire à une ischémie d’étendue modérée, en pratique peu invalidant et à seuil ischémique élevé.
5 . 5 - Traitement du SCA avec sus-décalage de ST non compliqué
5 . 5 . 1 - Prise en charge pré-hospitalière
Dès le diagnostic évoqué, soit par le médecin traitant appelé par le patient ou sa famille, soit par le médecin régulateur du SAMU contacté directement, ce dernier dépêche sur les lieux de l’accident une équipe médicalisée (SMUR).
Le diagnostic est évoqué sur la seule description des symptômes qui doivent être parfaitement connus ; il est confirmé par le médecin urgentiste après enregistrement de l’ECG durant la crise angineuse qui persiste à son arrivée.
Dès lors, le choix de la stratégie de revascularisation est discuté en tenant compte du délai écoulé depuis le début des symptômes et de celui qui serait nécessaire pour transférer le patient vers un hôpital équipé d’une salle de cathétérisme (stratégie différente en ville et à la campagne).
La décision de réaliser une ICP primaire justifie un transfert direct en salle de cathétérisme.
Dans tous les cas, la surveillance est faite durant les premiers jours en unité de soins intensifs coronaires (USIC).
5 . 5 . 2 - Prise en charge en USIC
La prise en charge comprend la surveillance clinique :
- mesure de la PA et auscultation biquotidienne ;
- monitorage ECG continu (rythme) ;
- électrocardiogramme biquotidien et à chaque nouvelle douleur (repolarisation) ;
- bilan biologique régulier (cycle enzymatique toutes les 6 heures durant les 12 premières heures, troponinémie, glycémie, créatininémie, NFS et numération plaquettaire en particulier quotidiennes jusqu’à décharge).
La durée de l’alitement et de la surveillance dépendent de l’existence d’éventuelles complications.
5 . 5 . 3 - Traitement symptomatique
- Antalgiques majeurs dérivés de la morphine sous-cutanée (SC) (chlorhydrate de morphine et apparentés) et anxiolytiques.
- Oxygénothérapie nasale (2–4 mL/min) proposée en cas de dyspnée.
- Dérivés nitrés per os utilisés à visée diagnostique (sus-décalage nitro-résistant).
- Nitrés : ils ne sont plus prescrits de manière systématique par voie veineuse. Ils sont délétères lorsque la nécrose s’étend au ventricule droit.
5 . 5 . 4 - Anti-agrégants plaquettaires
Attention
Posologies au programme ECN.
- Aspirine administrée initialement à raison de 250 à 500 mg par voie intraveineuse relayée par la prescription per os de 75 mg/j.
- Clopidogrel prescrit per os en dose de charge (300–600 mg), suivie d’une dose d’entretien de 75 à 150 mg/j.
5 . 5 . 5 - Anti-coagulants
Attention
Posologies au programme ECN.
L’anticoagulation par une héparine est proposée jusqu’à réalisation de la coronarographie ou la sortie du patient de l’hôpital (en l’absence de coronarographie). Elle n’est relayée par un traitement AVK que dans des cas particuliers (thrombus intraventriculaire gauche, fibrillation atriale, complication thrombotique veineuse).
Le choix de l’anticoagulant et sa posologie dépendent de la stratégie de reperfusion utilisée (ICP primaire, éventuellement associée à un traitement par anti-GPIIb/IIIa, FIV) :
- héparine non fractionnée (HNF) administrée en bolus initial de 60 U/kg (maximum 4000 UI si FIV), puis relayée par voie IV à la seringue électrique (12 UI/kg/h initial puis adapté au TCA mesuré à 3 h, 6 h, 12 h puis 2 fois/jour). Objectif TCA 1,5 à 2,5 fois le témoin. C’est le traitement habituellement retenu lorsqu’une ICP primaire est envisagée ;
- énoxaparine (seule héparine de bas poids moléculaire – HBPM – ayant l’AMM dans cette indication) prescrite en bolus IV de 3 000 UI (ou 50 UI/kg) puis relayée par une injection de 100 UI/kg SC toutes les 12 heures. C’est le traitement retenu chez les patients de moins de 75 ans en association à la FIV.
Le traitement initialement administré en bolus (HNF ou HBPM) doit être poursuivi par la suite. La succession HNF – HBPM ou inversement est à proscrire, car elle peut être responsable d’un sur-risque hémorragique.
5 . 5 . 6 - β-bloqueurs
Les β-bloqueurs sont prescrits :
- pour limiter l’extension de la nécrose, réduire l’incidence de survenue des troubles du rythme cardiaque ;
- à visée antalgique.
Ils sont utilisés en première intention par voie veineuse en cas de tachycardie (adrénergique), d’hypertension ou si la douleur persiste malgré l’administration d’un morphinique. Si la tachycardie paraît être en relation avec une poussée d’insuffisance cardiaque, il est prudent d’évaluer la tolérance du β-bloqueur en faisant appel dans un premier temps à un médicament à demi-vie courte.
Dans la majorité des cas, le traitement peut être prescrit d’emblée per os (ex : aténolol 100 mg/j).
Les β-bloqueurs sont prescrits précocement mais avec prudence et plutôt en USIC qu’au cours du transport médicalisé du fait du risque de décompensation cardiaque.
5 . 5 . 7 - Inhibiteurs de l’enzyme de conversion
Le traitement doit être débuté secondairement mais dans les 24 premières heures à doses progressives en tenant compte de la tolérance fonctionnelle et de la fonction rénale, en particulier si l’IDM est étendu (ex. : ramipril 1,25 mg/j, puis dose croissante progressive jusqu’à 10 mg/j).
5 . 5 . 8 - Reperfusion myocardique
5 . 5 . 8 . 1 - Les grands principes, notion de délais
La nécrose myocardique débute après 20 minutes d’occlusion coronaire. Elle s’étend à l’ensemble du myocarde concerné en 12 heures. La reperfusion est inutile au-delà de ce délai. Elle est d’autant plus utile qu’elle est précoce (efficacité maximale ? 2 h suivant le début de la douleur qui marque l’OCA).
La reperfusion mécanique par intervention coronaire percutanée (ICP) dite primaire (ICP-I) est plus efficace que la reperfusion chimique par fibrinolyse intraveineuse (FIV), mais une FIV très précoce est plus utile qu’une ICP trop tardive.
L’ICP peut être proposée en deuxième intention après échec de la FIV (ICP de sauvetage).
Le choix de la stratégie de reperfusion tient compte des possibilités respectives de réalisation des deux stratégies (contre-indications éventuelles), de deux données estimées : délai du premier contact médical (PCM) écoulé entre le début de la douleur et le diagnostic confirmé par l’ECG et délai de réalisation d’une ICP-I incluant temps de transfert du patient et de mise en place du ballon de reperfusion (délai ICP-I).
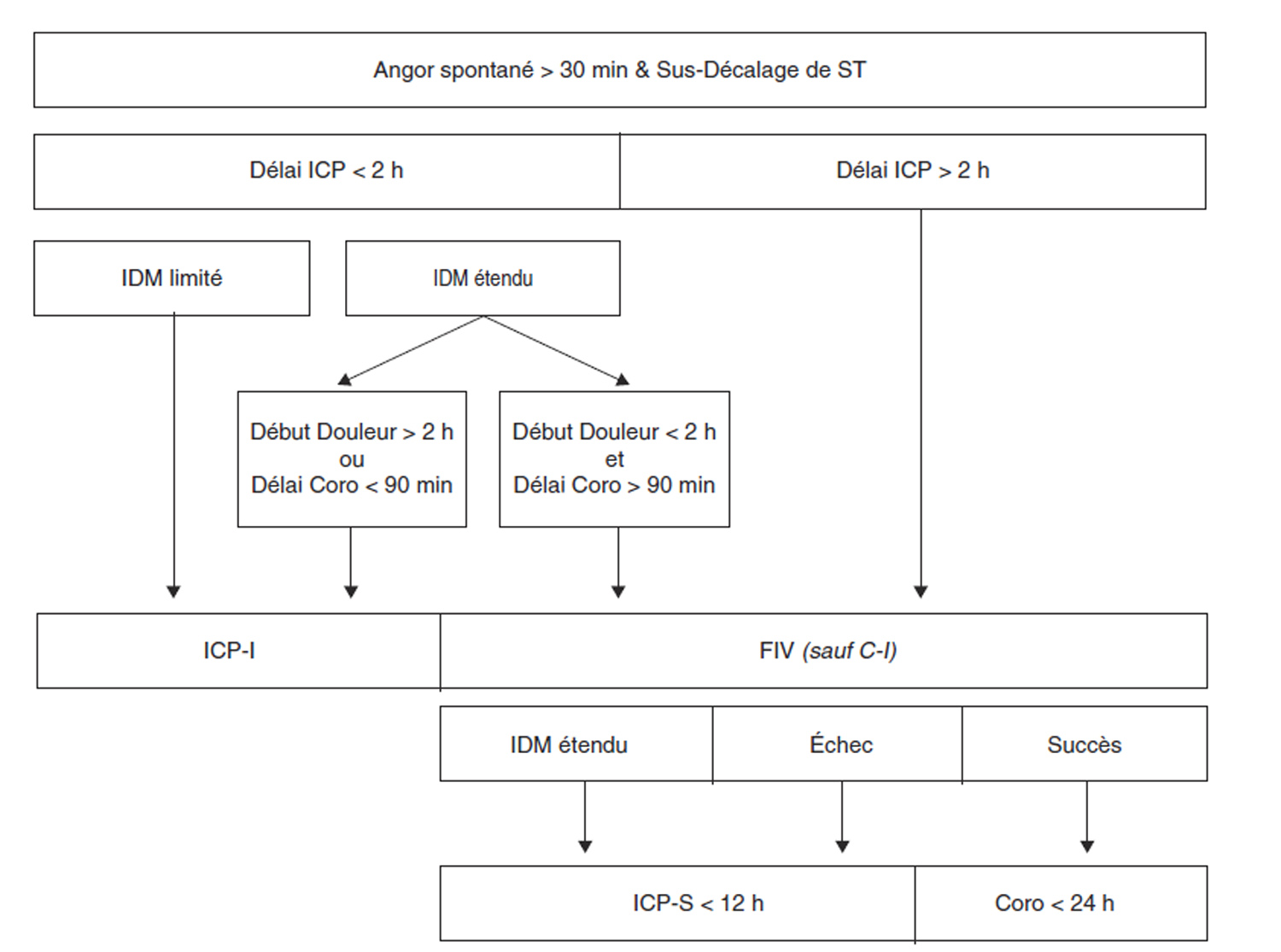
En pratique, la stratégie privilégiée est (en l’absence de contre-indication à la FIV) :
- ICP-I si son délai de réalisation est < 2 h ;
- FIV si le délai de réalisation de l’ICP-I est > 2 h ;
- FIV si ischémie étendue et PCM < 2 h et délai ICP-I > 90 min ;
- ICP-S en cas d’échec de la FIV et si le délai de réalisation de cette ICP-S est < 12 h ;
- coronarographie < 24 h (et revascularisation adaptée) en cas de succès de la FIV (figure 6).
Figure 6 : Stratégies de reperfusion en fonction des délais
5 . 5 . 8 . 2 - Reperfusion par ICP d’emblée (ICP-I)
La coronarographie est de préférence précédée ou accompagnée de l’administration par voie veineuse (bolus puis perfusion) d’un anti-GPIIb/IIIa associé aux antithrombotiques systématiques.
Elle confirme l’occlusion coronaire qui est immédiatement traitée (thrombo-aspiration par cathéter, dilatation par ballonnet et implantation d’une endoprothèse).
Les critères de reperfusion angiographique associent la restauration d’un flux épicardique normal et d’une perfusion capillaire normale.
La reperfusion s’accompagne habituellement d’une sédation de la douleur et d’une régression du sus-décalage du segment ST.
5 . 5 . 8 . 3 - Reperfusion par fibrinolyse intraveineuse (FIV)
Elle est pratiquée de préférence au domicile du patient (FIV pré-hospitalière) dès le diagnostic posé et après avoir éliminé les contre-indications liées au risque hémorragique.
5. 5. 8. 3. 1 - Contre-indications
- Âge > 75 ans, mais relative et fonction de l’état physiologique.
- Poussée ulcéreuse datant de moins de 6 mois.
- Intervention de chirurgie générale < 10 jours.
- Intervention de chirurgie générale vasculaire < 1 mois.
- Accident vasculaire cérébral, malformation vasculaire cérébrale.
- Traumatisme crânien récent (ex. : syncope et chute lors du SCA).
- HTA non contrôlée, supérieure à 200 mmHg.
- Massage cardiaque récent, mais relatif en fonction de la gravité du tableau.
- Ponction récente de gros vaisseaux non comprimables.
- Injection intramusculaire (risque d’hématome induit).
- Insuffisance hépatocellulaire grave.
- Grossesse et post-partum (l’IDM est très rare dans cette situation).
- Trouble de l’hémostase ou diathèse hémorragique (tendance au saignement inexpliquée, épistaxis…).
5. 5. 8. 3. 2 - Molécules utilisées
- Streptokinase (Streptase®) : fibrinolytique de première génération non spécifique de la fibrine (fibrinogénolyse périphérique), abandonné au profit de produits plus efficaces, mieux tolérés (allergies) et de maniement plus simple.
- Activateur tissulaire du plasminogène (t-PA : Actilyse®) : fibrinolytique spécifique prescrit en bolus suivi d’une perfusion, il est plus efficace que la streptokinase. Il est actuellement remplacé par le TNK-tPA aussi efficace mais de maniement plus simple.
- TNK-tPA (Metalyse®) : injecté en simple bolus suivant une dose adaptée au poids (0,53 mg/kg), associé à une héparinothérapie durant 48 heures ou jusqu’à réalisation de la coronarographie et de l’ICP. Il peut être associé à l’énoxaparine chez les sujets < 75 ans.
5. 5. 8. 3. 3 - Critères d’efficacité
Ils conditionnent la suite de la prise en charge et en particulier la date voire l’heure de réalisation de la coronarographie. La reperfusion est obtenue dans les 90 minutes suivant l’administration du bolus de TNK-tPA dans 50 à 60 % des cas. Elle se traduit par un syndrome de reperfusion (SR) associant régression rapide (> 60–90 min) et simultanée de la douleur et du sus-décalage du segment ST (régression > 70 % dans la dérivation où il est maximal). Le SR peut être absent malgré un succès confirmé par l’angiographie. La reperfusion peut être associée à un trouble du rythme ventriculaire, un bloc auriculoventriculaire (en particulier après désobstruction coronaire droite), une augmentation paradoxale de la douleur et du sus-décalage de ST, un syndrome hypotension – bradycardie (sus-décalage inférieur par occlusion coronaire droite [IDM inférieur]), incidents en règle facilement corrigés et transitoires.
5. 5. 8. 3. 4 - Complications
Malgré le respect des contre-indications, la survenue d’un AVC est notée dans 2 % des cas hémorragique une fois sur deux. La FIV justifie une adaptation du traitement anticoagulant et souvent son arrêt avec des conséquences très péjoratives sur le pronostic immédiat et ultérieur.
5. 5. 8. 3. 5 - Stratégie complémentaire (combinée)
- La reperfusion expose au risque secondaire de réocclusion (RO), en particulier si le traitement anti-agrégant plaquettaire est interrompu du fait d’une complication hémorragique. Elle se traduit par la réapparition a minima des signes cliniques et électrocardiographiques (récidive ischémique), suivie d’une nouvelle augmentation du taux de CK-MB (la troponinémie n’est pas influencée).
- Le risque de RO justifie le transfert médicalisé (SAMU) des patients suivant leur primo-admission vers un centre de cardiologie interventionnelle en vue de la réalisation d’une coronarographie systématique et, en fonction des résultats, d’une revascularisation par ICP (ICP secondaire) ou pontage coronaire. Ce transfert doit être réalisé dans les 48 heures suivant l’administration du fibrinolytique. Il doit être plus précoce (éventuellement héliporté, toujours médicalisé) en cas d’évolution défavorable (survenue d’une complication) ou en l’absence de SR, 60 minutes après l’administration du fibrinolytique en vue de la réalisation d’une ICP (ICP de sauvetage).
5 . 6 - Traitement des complications du SCA avec sus-décalage de ST
5 . 6 . 1 - Troubles du rythme ventriculaire précoces
Le traitement anti-arythmique de première intention est la lidocaïne (Xylocaïne® : 1 mg/kg en bolus suivi d’un relais de 20 mg/kg/24 h en seringue électrique). Il est proposé dans les situations suivantes :
- extrasystoles ventriculaires nombreuses, polymorphes, en doublets ou triplets avec un phénomène R sur T ;
- tachycardie ventriculaire (TV), après choc électrique externe (CEE) si elle est soutenue et mal tolérée (300 J sous brève AG si le patient est conscient) ;
- fibrillation ventriculaire, après massage cardiaque externe et CEE.
Le rythme idioventriculaire accéléré (RIVA = TV lente à fréquence voisine de 80 bpm) ne nécessite aucun traitement, sauf s’il est mal toléré (rarement et si IDM étendu). Il peut être réduit par accélération du rythme auriculaire (atropine, stimulation électrique).
5 . 6 . 2 - Troubles du rythme ventriculaire tardifs
Les troubles du rythme ventriculaire sévères sont le plus souvent associés à une altération de la fonction VG.
La prévention de la mort subite passe par l’amélioration de la fonction contractile VG, la prescription systématique d’un β-bloqueur et l’implantation d’un défibrillateur lorsque la FE est < 30 %.
5 . 6 . 3 - Troubles du rythme supraventriculaire (précoces)
Les digitaliques sont contre-indiqués à la phase aiguë et les anti-arythmiques de classe IA et IC sont contre-indiqués ultérieurement à titre préventif.
La réduction du trouble du rythme est justifiée lorsqu’il est mal toléré au plan hémodynamique.
Sa survenue justifie un traitement anticoagulant au long cours (AVK) en particulier si la fonction VG est altérée et le patient est âgé.
5 . 6 . 4 - Bradycardie sinusale et troubles de la conduction
Le BAV transitoire de l’IDM inférieur relève d’un traitement par atropine IV (1/2 à 1 mg IV lente) lorsqu’il est symptomatique et nécessite, plus rarement, un entraînement électrosystolique temporaire.
Le BAV compliquant l’IDM antérieur nécessite toujours la mise en place d’une sonde d’entraînement électrosystolique. Dans l’attente, la fréquence cardiaque peut être accélérée par l’administration prudente d’isoprénaline (Isuprel® cinq ampoules dans 250 mL de sérum glucosé 5 %, débit à adapter pour obtenir la fréquence voulue), malgré le risque de déclencher une arythmie ventriculaire maligne. La rapidité de son installation justifie la mise en place préventive d’une sonde de stimulation s’il apparaît un bloc alternant, signe d’atteinte trifasciculaire.
5 . 6 . 5 - Insuffisance cardiaque et choc cardiogénique
- Insuffisance ventriculaire gauche minime à modérée. Traitement non spécifique : diurétiques et inhibiteurs de l’enzyme de conversion.
- Choc cardiogénique :
- corriger les facteurs aggravants : hypovolémie, troubles du rythme ; lutter contre la sidération myocardique : inotropes positifs (dobutamine) ;
- le traitement peut être adapté en recueillant par cathétérisme intracardiaque droit (sonde de Swan-Ganz) les pressions capillaires, pulmonaires, ventriculaires et auriculaires, et en mesurant régulièrement le débit cardiaque par thermodilution (sonde introduite par voie veineuse brachiale et laissée en place durant la durée de la surveillance) ;
- traitement interventionnel : assistance circulatoire par mise en place d’un ballon de contre-pulsion intra-aortique (CPBIA), revascularisation par angioplastie ou chirurgie (pontage), assistance cardiaque par circulation extracorporelle (plus rarement), assistance cardiocirculatoire par cœur artificiel (exceptionnel) en attente d’une transplantation cardiaque (sujet jeune).
5 . 6 . 6 - Complications mécaniques
Elles relèvent d’un traitement chirurgical. Les difficultés techniques sont liées au caractère inflammatoire des lésions traitées et friable du myocarde, source de complications ultérieures (lâchage de sutures). La préparation préopératoire consiste en la mise en place d’une assistance circulatoire par ballon de contre-pulsion intra-aortique associée à la prescription d’un support inotrope et de diurétiques.
On distingue :
- rupture de la paroi libre du ventricule gauche, le plus souvent rapidement mortelle. Il est exceptionnel que le patient puisse être confié promptement à une équipe chirurgicale ;
- rupture septale, corrigée par suture chirurgicale d’un patch de fermeture. La fermeture par implantation percutanée d’une prothèse est exceptionnellement envisagée. Le délai de réparation dépend de la tolérance clinique. Les résultats du geste chirurgical sont meilleurs si la procédure peut être différée de quelques jours (shunt de volume modéré) ;
- insuffisance mitrale par rupture de pilier, corrigée par remplacement valvulaire.
6/9