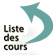- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Définition
- 2 - Agents pathogènes
- 3 - Pouvoir pathogène et facteurs favorisants
- 4 - Réservoirs et modes de contamination
- 5 - Diagnostic clinique et radiologique des aspergilloses
- 6 - Diagnostic biologique des aspergilloses
- 7 - Diagnostic des autres moisissures opportunistes
- 8 - Traitement
- 9 - Prévention : mesures associées
- Points essentiels
-
Version PDF

-
Contenu
- Evaluations
- Annexes
6 - Diagnostic biologique des aspergilloses
6 . 1 - Les prélèvements
Ils peuvent être ciblés en fonction des points d’appel cliniques, ou sanguins pour la mise en évidence d’une dissémination hématogène.
Le prélèvement doit se faire dans des conditions d’asepsie, dans un récipient stérile, et conservé à 4°C en attendant son acheminement rapide au laboratoire.
L’isolement d’Aspergillus de produits biologiques issus de sites stériles (biopsies d’organes à l’aiguille ou chirurgicales, liquide céphalo-rachidien, urines) affirment le diagnostic. L’isolement d’Aspergillus de sites anatomiques pouvant être colonisés (arbre respiratoire ou sites superficiels) est d’interprétation plus délicate et doit prendre en compte le contexte clinique et l’ensemble des arguments diagnostiques. Les prélèvements respiratoires protégés (liquide de LBA, prélèvement transtrachéal protégé, par exemple) auront une valeur supérieure à l’examen des expectorations.
Les hémocultures sont le plus souvent négatives dans les aspergilloses invasives mais peuvent être positives dans les fusarioses disséminées et dans la pénicilliose à P. marneffei.
6 . 2 - Examen direct et cultures mycologiques
Le diagnostic mycologique doit être effectué par un laboratoire expérimenté, et doit associer un examen direct et une culture sur milieu spécifique.
Examen direct
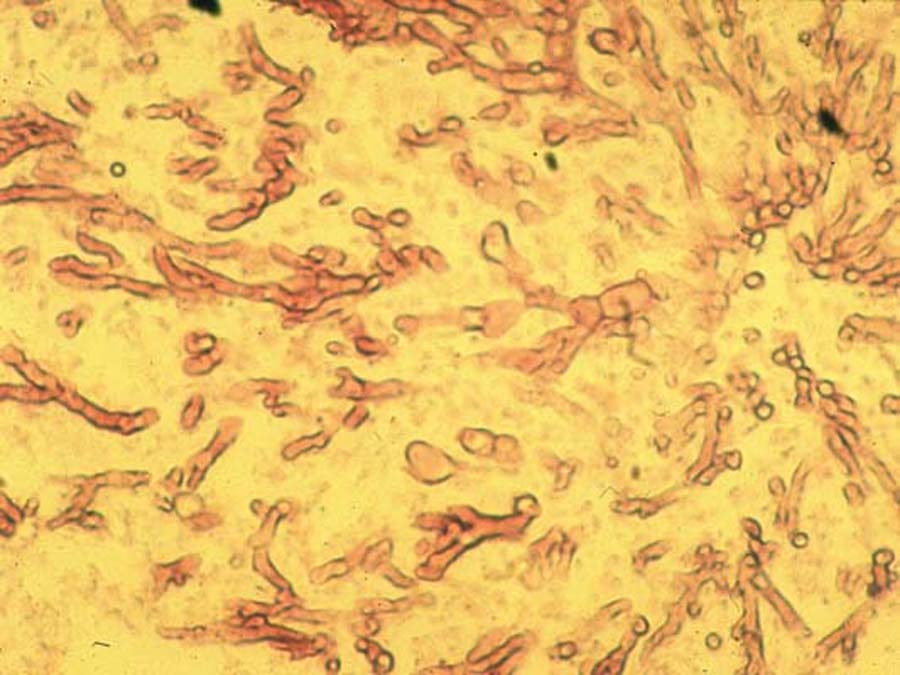
Il permet la mise en évidence de filaments mycéliens de "type aspergillaire", en faveur d'une infection plutôt qu'une colonisation. Entre lame et lamelle, ils mesurent de 2 à 4 µm de diamètre, apparaissent hyalins, cloisonnés, et parfois ramifiés (dichotomie avec angles aigus à 45°). Rarement, des têtes aspergillaires peuvent être observées (prélèvements au cours de sinusites, d’aspergillome ou d’otites notamment).
Des méthodes de marquage (noir chlorazole, calcofluor) ou des colorations (coloration argentique de Gomori-Grocott, Giemsa) peuvent augmenter la sensibilité de l’examen. La seule présence de filaments « de type aspergillaire » est présomptive d’aspergillose, mais peut aussi correspondre à d’autres hyphomycoses.
Figure 10 : Filaments mycéliens de "type aspergillaire"
Culture et identification
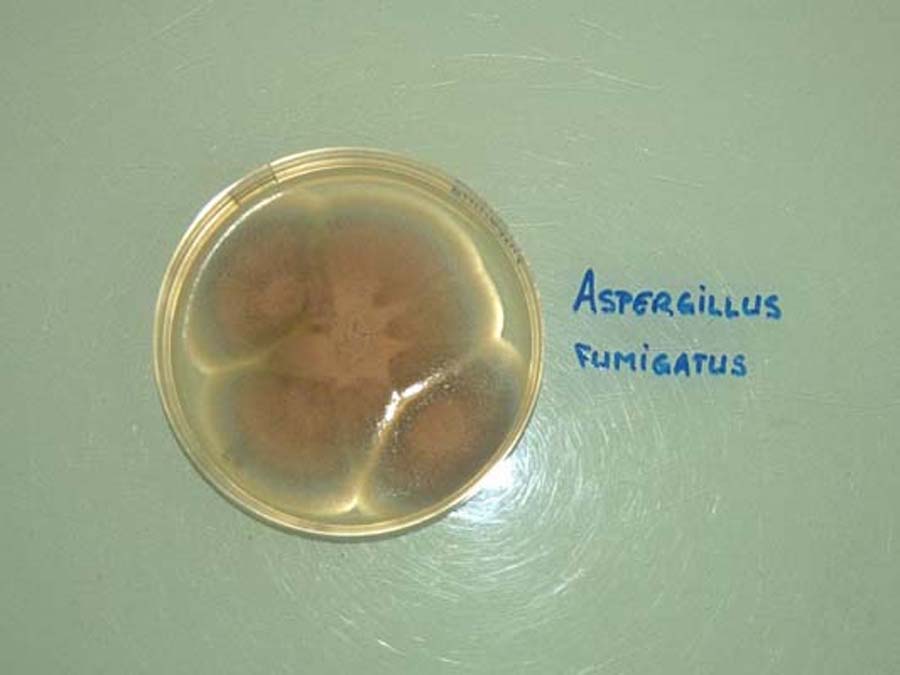
Elle se fait sur milieu fongique spécifique et permet l’identification précise du genre et de l’espèce du champignon. Aspergillus pousse en 3 à 5 jours à 37°C.
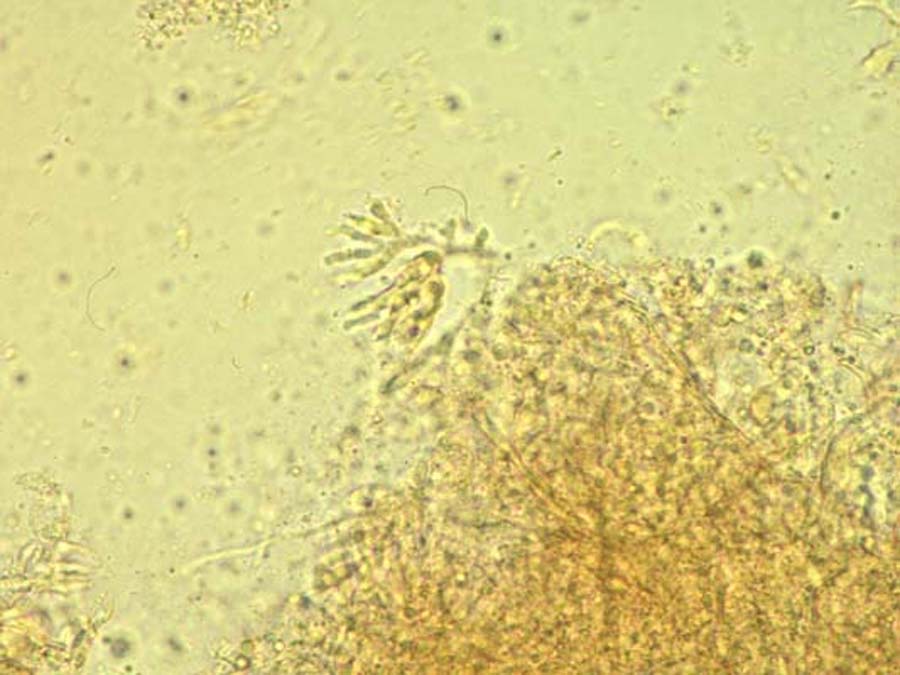
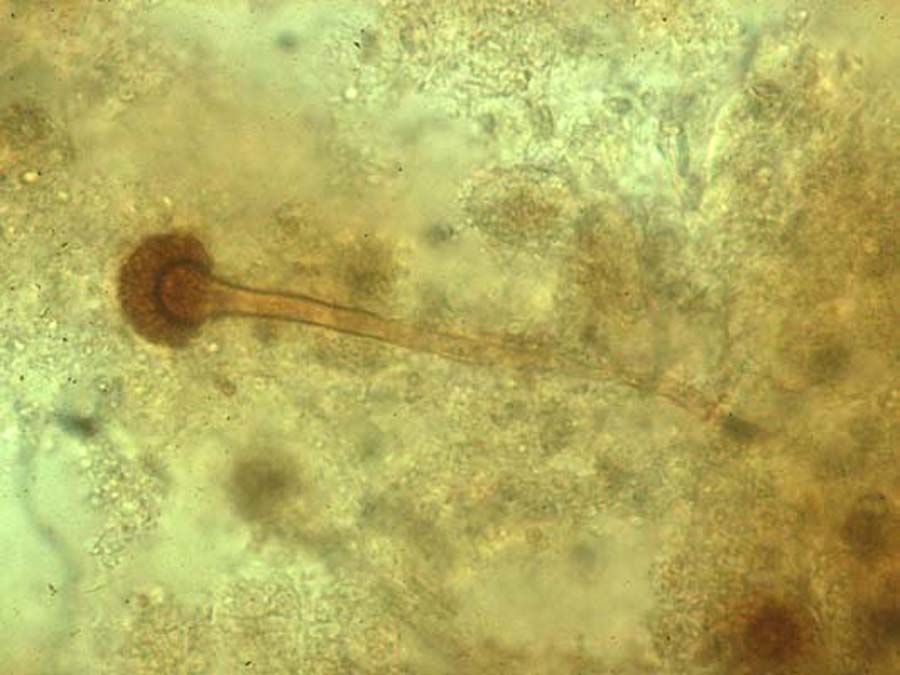
L’aspect macroscopique est ras à poudreux, velouté parfois cotonneux, et de couleur variée en fonction de l’espèce. L’analyse microscopique de la culture met en évidence le conidiophore et la tête aspergillaire, dont les caractéristiques affineront l’identification.
Les milieux spécifiques classiquement utilisés sont le milieu de Sabouraud (sans cycloheximide qui inhibe de nombreuses espèces d’ Aspergillus), le milieu à l’extrait de malt ou le milieu de Czapek. A. fumigatus est l’espèce la plus fréquemment retrouvée et ses colonies sont blanc-vert à 48-72 h et vert-gris plus tardivement.
Portée par le conidiophore, la tête aspergillaire (forme de fructification asexuée) est composée d’une vésicule, d’une rangée de phialides (cellules conidiogènes) portée ou non par une rangée de métules, et de conidies (ou phialospores) de 2 à 4 micromètres de diamètre.
6 . 3 - Examen anatomopathologique
Il peut mettre en évidence des filaments mycéliens septés "de type aspergillaire" ou non septés « de type mucorale » et peut objectiver un processus d’invasion tissulaire. L'examen anatomopathologique fait appel à des colorations non spécifiques (hémalun éosine safran, periodic acide Schiff) ou spécifiques basées sur la coloration argentique qui colore la paroi fongique.
6 . 4 - Biologie moléculaire
Plus récemment, des techniques d’amplification génique ont été développées. Deux aspects limitent encore leur utilisation en routine :
- très rapides, ces techniques nécessitent toutefois un équipement spécifique,
- très sensibles, elles rendent délicate la distinction entre la colonisation (portage asymptomatique) et l’infection réelle. L’optimisation des techniques d’amplification (notamment la PCR en temps réel) et des méthodes de typage moléculaire, laisse envisager un intérêt grandissant pour ces méthodes.
6 . 5 - Détection d’anticorps (diagnostic indirect) et d’antigènes
6 . 5 . 1 - Détection d’anticorps circulants
Elle traduit la réponse immunitaire humorale d’un hôte immunocompétent au contact du champignon et constitue un argument majeur pour le diagnostic de l’aspergillome et des aspergilloses localisées et immunoallergiques. La technique de référence reste la mise en évidence d’anticorps précipitants (précipitines) par immunoélectrophorèse (IEP), double-diffusion (méthode d’Ouchterlony) ou par électrosynérèse (ES). La positivité du test prend en compte le nombre et l’activité enzymatique (catalasique ou chymotrypsique) des arcs précipitants. Des techniques de dépistage rapides, mais moins spécifiques, peuvent également être utilisées (ELISA ou hémagglutination entre autres). L’absence de réponse humorale au cours de diverses immunodépressions rend l’interprétation des résultats délicate dans le diagnostic d’aspergillose invasive.
En parallèle, la recherche des IgE spécifiques est un argument biologique supplémentaire au cours des aspergilloses immuno-allergiques.
6 . 5 . 2 - Détection d’antigènes circulants
Une recherche positive dans le sang est un argument biologique majeur pour le diagnostic de l’aspergillose invasive, en particulier chez le patient neutropénique. Il est actuellement recommandé d’utiliser une technique ELISA pour détecter l'antigène galactomannane présent dans la paroi d’Aspergillus fumigatus, technique rapide et surtout plus sensible que le test d’agglutination latex.
Il subsiste toutefois des limites :
- la sensibilité est estimée à 70-80% dans la population des greffés de cellules souches hématopoïétiques, pour qui l’on recommande de faire une détection systématique bi-hebdomadaire sur le sérum.
- l’existence de faux positifs induits par certains médicaments et aliments (valeurs élevées sont retrouvées dans la population pédiatrique), impose la confirmation de toute détection douteuse ou positive sur un second prélèvement.
Plusieurs causes de fausse positivité ont été objectivées : translocation à partir d’antigène galactomannane présent dans l’alimentation (céréales, pâtes, lait etc…), réaction croisée avec des antigènes pariétaux d’autres champignons, réaction croisée avec certains médicaments.
Alors que le test n’est validé que pour la détection d’antigène sérique, des travaux évoquent son intérêt pour la détection dans le LBA ou le LCR.
6 . 6 - Signes non spécifiques
L’hyperéosinophilie sanguine et l’augmentation des IgE totales sont des marqueurs non spécifiques qui doivent être recherchés au cours des aspergilloses immuno-allergiques.
6 . 7 - Principales indications des tests diagnostiques
Principales indications des tests diagnostiques
| Mise en évidence du champignon (mycologie, histologie, biologie moléculaire) | Détection d’anticorps circulants | Détection d’antigènes circulants | Marqueurs non spécifiques (éosinophilie, et IgE totales) | ||
| Aspergillome | + | ++ | |||
| Aspergillose localisée | + | + | |||
| Aspergillose invasive | + | +/- | + | ||
| Aspergilloses immuno-allergiques | ABPA | +/- | + | + |
|
| Asthme | + | ||||
| Alvéolite allergique extrinsèque | + | ||||
7/10