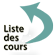- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Le parasite
- 2 - Cycle
- 3 - Modes de contamination
- 4 - Répartition géographique, épidémiologie
- 5 - La toxoplasmose chez l'homme
- 6 - Toxoplasmose acquise post-natale du sujet immunocompétent
- 7 - Toxoplasmose de l’immunodéprimé
-
8 - Toxoplasmose congénitale
- 8.1 - Définition et risque
- 8.2 - Prévention : dispositions légales et recommandations
- 8.3 - Prévention : mesures prophylactiques (circulaire de 1983)
- 8.4 - Clinique
- 8.5 - Diagnostic anténatal
- 8.6 - Diagnostic néonatal
- 8.7 - Prise en charge diagnostique et thérapeutique de la grossesse à risque
- 8.8 - Prise en charge diagnostique et thérapeutique à la naissance
- 9 - Cas particulier de la toxoplasmose oculaire
- Points essentiels
-
Version PDF

-
Contenu
- Evaluations
- Annexes
7 - Toxoplasmose de l’immunodéprimé
7 . 1 - Clinique
C’est une maladie grave, constamment mortelle sans traitement sauf les formes oculaires isolées qui peuvent conduire à la cécité. Les descriptions classiques distinguent les formes localisées et les formes disséminées mais la réalité est souvent moins tranchée.
Toxoplasmose localisée :
- La localisation la plus fréquente est cérébrale (figure 4) ; le tableau clinique est celui d’un abcès. La symptomatologie associe des céphalées persistantes, une fièvre dans 50% des cas et secondairement un déficit focalisé en rapport avec la localisation du ou des abcès. Une crise comitiale inaugurale est possible. La révélation sous forme d’une crise comitiale est fréquente.
Figure 4 : Toxoplasmose de l ’immunodéprimé : Abcès cérébral
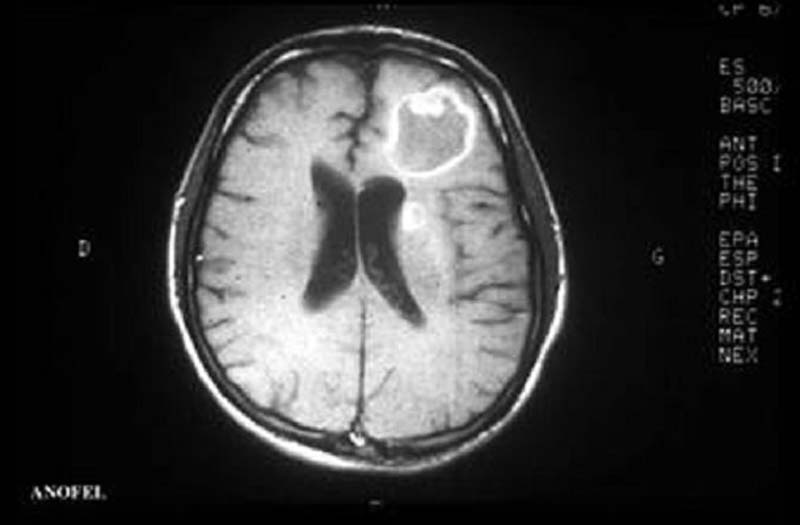
- La seconde localisation la plus fréquente est oculaire (figure 5). Le patient se plaint d’une baisse d’acuité visuelle, d’impression de « mouches volantes » et d’une rougeur oculaire. Le diagnostic est ophtalmologique. Au cours de l’infection par le VIH une localisation cérébrale est associée dans 40% des cas.
- La toxoplasmose pulmonaire se traduit par une pneumopathie fébrile dyspnéisante évoquant la pneumocystose.
- Le tachyzoïte de T. gondii pouvant pénétrer dans n’importe quel type de cellules, la littérature est riche de cas rapportés dans les localisations les plus diverses, le diagnostic étant apporté par l’examen anatomo-pathologique, l’inoculation à l’animal ou la biologie moléculaire.
Toxoplasmose disséminée :
Le problème est celui d’une fièvre isolée dont le diagnostic n’est parfois fait que sur les localisations viscérales secondaires.
7 . 2 - Quels patients ?
Deux situations différentes sont possibles en matière d’immunodépression :
- La réactivation d’une toxoplasmose ancienne chez les patients souffrant d’un déficit important de l’immunité cellulaire T. En pratique il s’agit le plus souvent de patients infectés par le VIH avec des CD4 inférieurs à 100/mm3 ou de patients greffés de moelle, sans prophylaxie. Peuvent également être concernés les patients atteints de cancers ou de syndromes lymphoprolifératifs ; les chimiothérapies anticancéreuses et la corticothérapie sont des éléments favorisants mais des cas ont été décrits au cours de maladie de Hodgkin avant la mise au traitement ou très à distance de celui-ci.
- Une primo-infection le plus souvent secondaire à une transmission par le greffon lors de la greffe d’un organe solide d’un donneur séropositif pour la toxoplasmose vers un receveur négatif en pré-greffe. L’organe le plus souvent en cause est le myocarde (risque >50% en cas de mis-match).
7 . 3 - Dispositions légales et recommandations
Afin d’organiser au mieux la prise en charge de ces situations, la loi française (décret n°97-928 du 9 octobre 1997) impose le dépistage sérologique (donneur et receveur) pour tout prélèvement d’organes, de tissus ou de cellules d’origine humaine.
Le rapport de prise en charge des personnes infectées par le VIH recommande le dépistage systématique de la toxoplasmose lors du bilan initial. Si ce dépistage est négatif, le patient doit être informé des mesures prophylactiques (circulaire de 1983, voir Chapitre 18) et une surveillance sérologique semestrielle doit être instaurée. Si ce dépistage est positif, une prophylaxie primaire doit être prescrite lorsque le taux de CD4 est inférieur à 100/mm3.
En pratique, dans toutes les situations d’immunodépression, existantes ou programmées, le statut sérologique à l’égard de la toxoplasmose doit être établi avant toute prescription susceptible d’interférer dans les résultats (transfusion ou perfusion d’immunoglobulines).
7 . 4 - Diagnostic biologique
Chez les patients réactivant une toxoplasmose ancienne la sérologie ne permet jamais d’affirmer que l’épisode clinique aigu est bien en rapport avec la toxoplasmose, elle permet seulement d’envisager le diagnostic comme possible et c’est la recherche du parasite, ou l’efficacité du traitement d’épreuve, justifié devant un tableau d’abcès cérébral, qui confirmeront le diagnostic. La recherche du toxoplasme peut être faite par coloration optique, marquage avec des anticorps monoclonaux, inoculation à l’animal ou PCR à partir de n’importe quel prélèvement biologique (LBA, LCR, sang périphérique, moelle…).
Dans les cas de primo-infection (contamination par le greffon) la sérologie reste contributive, toutefois avec un retard d’apparition des anticorps en rapport avec les traitements immuno-suppresseurs, ce qui justifie la recherche directe en cas de signe clinique évocateur.
Par contre, chez les greffés d’organe solide séropositifs pour le toxoplasme en pré-greffe, une réactivation sérologique portant sur les IgG est possible en post-greffe, parfois accompagnée de la réapparition des autres isotypes, mais le plus souvent sans conséquence clinique.
7 . 5 - Traitement
Le traitement d’attaque de référence est l’association pyriméthamine (Malocide®, 50 à 75 mg/j, après une dose de charge de 100 mg le premier jour) et sulfadiazine (Adiazine®, 4 à 6 g/j). Dans 40 à 60 % des cas ce traitement est cause d’effets indésirables :
- exanthème, volontiers fébrile, cédant le plus souvent sous traitement symptomatique. Une surveillance clinique rigoureuse est nécessaire du fait du risque de syndrome de Stevens-Johnson et de syndrome de Lyell.
- toxicité hématologique principalement due à la pyriméthamine.
L’alternative à la sulfadiazine, en cas d’intolérance, est la clindamycine (2,4 g/j).L’association trimethoprime-sulfamethoxaxole (10-50 mg/kg, 15-75 mg/kg IV la première semaine en cas de trouble de conscience), utilisable par voie veineuse ou orale, a une efficacité équivalente, une meilleure tolérance et peut être instaurée en première intention. Quel que soit le traitement choisi, il sera maintenu en attaque pendant 3 à 6 semaines avec une prescription systématique d’acide folinique 25 mg/j pour en prévenir les effets secondaires hématologiques.
La prophylaxie primaire comme secondaire est réalisée par l’association triméthoprime-sulfaméthoxazole (Bactrim®), à la posologie de 1 cp à 160 mg/800 mg par jour.
7/9