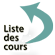2 - Physiopathologie
2 . 1 - Rappel sur le métabolisme du Fer
Du fait de sa capacité à échanger des électrons en situation d’aérobie, le fer est indispensable au fonctionnement cellulaire et notamment à la synthèse de l’ADN, à la respiration cellulaire et au transport de l’oxygène. L’excès de fer conduit, cependant, à des dommages tissulaires, en catalysant la conversion du peroxyde d’hydrogène en radicaux libres susceptibles d’attaquer les membranes cellulaires, les protéines et l’ADN.
Le stock normal de fer est de 35-45 mg/kg chez l’homme, un peu inférieur chez la femme en période d’activité génitale (environ 35 mg/kg). La majorité du fer est incorporé dans l’hémoglobine (60%), tandis que 10-15% sont retrouvés dans la myoglobine musculaire, et les cytochromes (10%). Le fer circulant, lié à la transferrine, ne représente qu’une faible proportion (1%). Le foie (1000 mg) et les macrophages du tissu réticulo-endothélial constituent les principaux sites de stockage du fer.
Dans les conditions physiologiques (Figure 1.A), 1-2 mg de fer est éliminé chaque jour par la transpiration et la desquamation des cellules cutanées et intestinales, ou chez la femme pendant les règles. Cette perte est compensée par l’apport alimentaire. L’absorption intestinale du fer s’effectue au niveau du duodénum. Le fer alimentaire, réduit à l’état ferreux, est capté au pôle apical de l’entérocyte puis internalisé grâce à DMT1 (divalent metal transporter 1). Il peut alors être stocké dans l’entérocyte sous forme de ferritine ou être relargué dans la circulation, au pôle baso-latéral grâce à la Ferroportine. Dans le sang, le fer circule lié à la transferrine. Le complexe est capté par les cellules utilisatrices, en particulier l’hépatocyte, grâce aux récepteurs de la transferrine (TRF1 et 2) et s’accumule dans les cellules sous forme de ferritine. Les macrophages récupèrent le fer ferrique des érythrocytes vieillissants et le refixent sur la transferrine pour une distribution aux tissus. Il n’y a pas de régulation de l’élimination du fer, c’est donc son absorption intestinale qui conditionne le stockage du fer dans l’organisme et explique qu’une dysrégulation de l’absorption puisse conduire à une surcharge en fer.
L’expression des transporteurs (DMT1 et Ferroportine) dépend des stocks de fer intra cellulaire. L’hepcidine, peptide de 25 AA synthétisé par le foie, est l’hormone de régulation de l’absorption du fer. Elle agit sur la ferroportine pour inhiber le transport du fer, entraînant une diminution de son absorption et une augmentation de sa rétention dans les macrophages et les cellules de Kupfer. La synthèse de l’hepcidine diminue lorsque les besoins en fer augmentent.
Dans l’hémochromatose primitive :
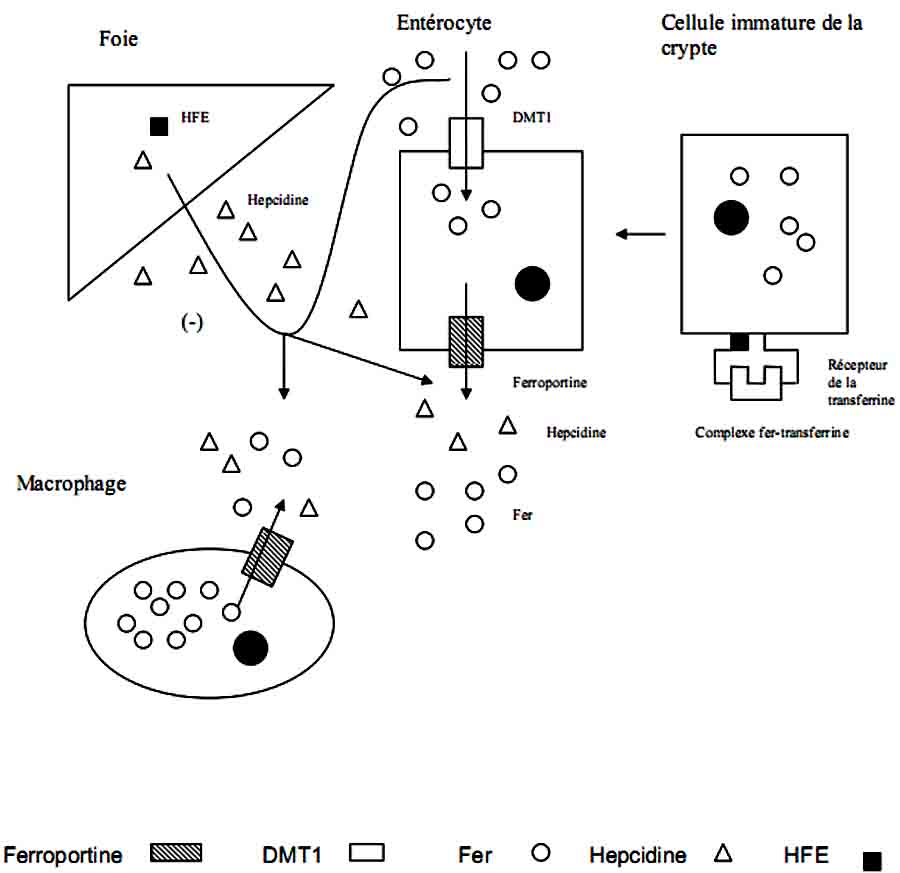
- l’expression des transporteurs DMT1 et Ferroportine est augmentée de manière inappropriée, ce qui conduit à une absorption de fer supérieure aux pertes journalières et à son accumulation progressive dans l’organisme (Figure 1.B).
- l’hepcidine est effondrée, d’où un majoration du transport en fer. Le mécanisme par lequel les protéines impliquées dans la survenue d’une hémochromatose régulent l’expression de l’hepcidine est mal connu. Le rôle important de l’hepcidine est souligné par le fait que, chez les souris transgéniques présentant une hémochromatose, une surexpression de l’hepcidine prévient la survenue de la surcharge en fer.
En cas d’inflammation, la synthèse de l’hepcidine est augmentée. De ce fait, dans les anémies inflammatoires, il existe une diminution de l’absorption du fer et une rétention élevée dans le système macrophagique.
2 . 2 - Aspects génétiques
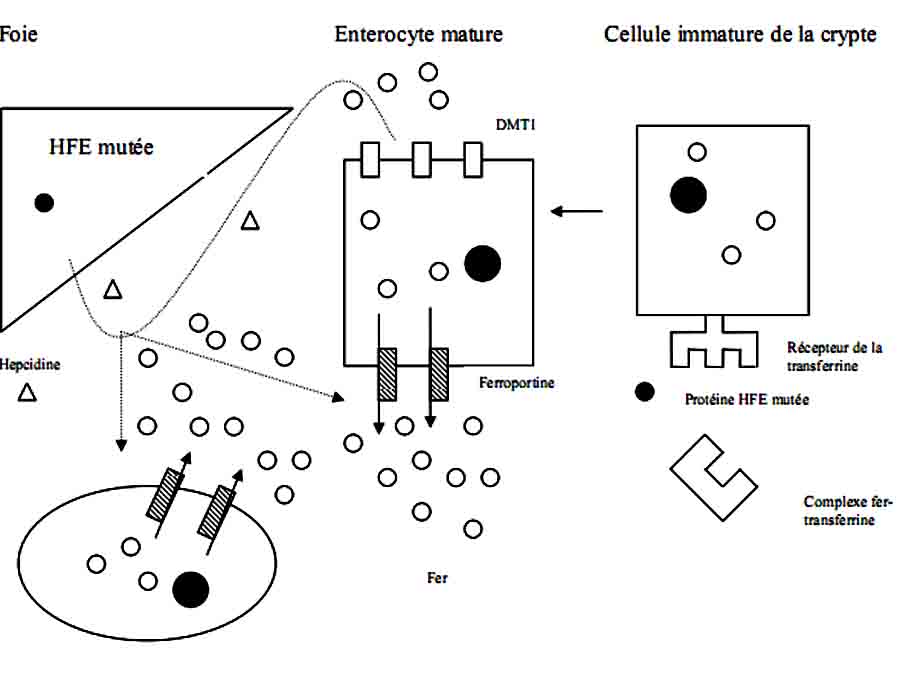
On sait depuis 1996, que la forme classique de l’hémochromatose primitive, représentant plus de 95% des cas, est liée au gène HFE (tableau 2). Il code pour une protéine du complexe majeur d’histocompatibilité de classe I HLA. Deux mutations ponctuelles C282Y et H63D ont été identifiées. La mutation C282Y (Cys 282 Tyr : remplacement, en position 282, d’une cystéine par une tyrosine) est la plus fortement associée à l’hémochromatose. En France, 90% des patients porteurs d’une hémochromatose sont homozygotes pour la mutation C282Y (hémochromatose de type 1). La transmission s’effectue sur un mode autosomique récessif mais la pénétrance est incomplète et l’expressivité variable.
L’hétérozygotie simplex C282Y n’a pas d’expression clinique. La seconde mutation H63D du gène HFE (His 63 Asp : remplacement, en position 63, d’une histidine par un acide aspartique) n’est impliquée qu’en cas d’association à la précédente chez des patients hétérozygotes composites C282Y/H63D.
D’autres mutations touchant d’autres gènes ont également été identifiées ; elles sont exceptionnelles (tableau 2).