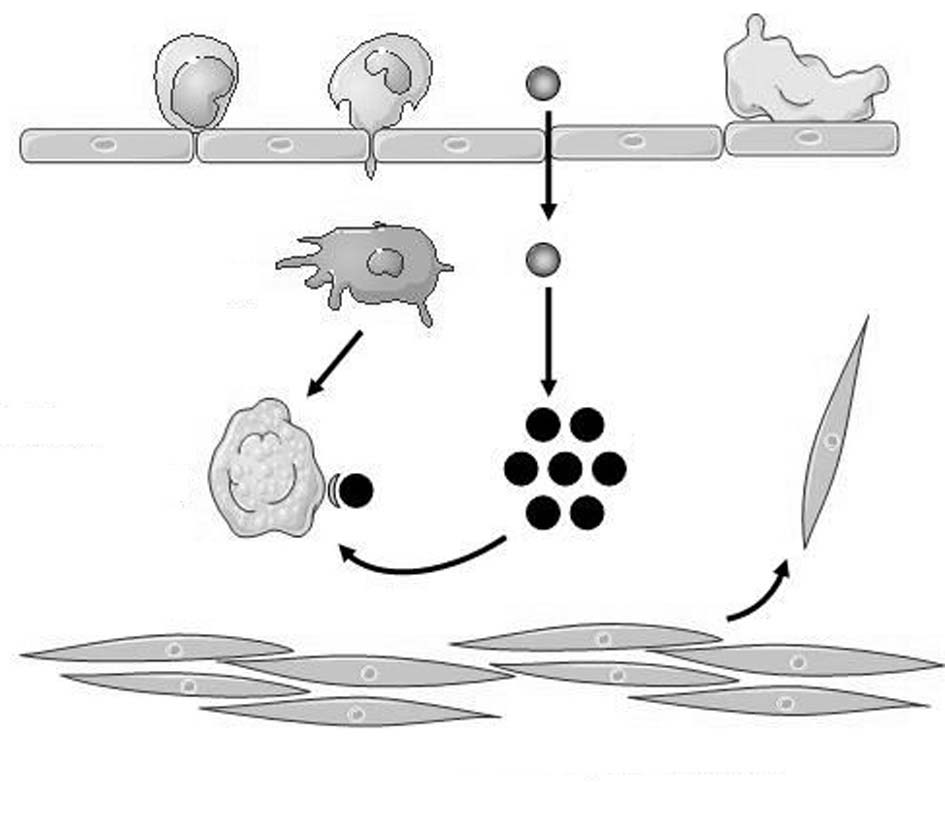
A : transcytose et fixation sous-intimale ; B : oxydation des LDL ; C : adhésion des monocytes et diapédèse ; D : transformation des monocytes en macrophages ; E : accumulation des LDL oxydées dans le macrophage qui se transforme en cellules spumeuses ; F : recrutement des cellules musculaires lisses, migration et dédifférenciation ; G : dysfonction endothéliale et adhésion plaquettaire.
- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Épidémiologie
- 2 - Mécanismes de l'athérosclérose
- 3 - Points d'impact des thérapeutiques
- 4 - Localisations préférentielles des lésions d'athérosclérose
- 5 - Évolution naturelle de la maladie athéromateuse
-
6 - Le malade polyathéromateux
- 6.1 - Définition
- 6.2 - Prévalence de l’atteinte polyartérielle
- 6.3 - Prise en charge de tout malade polyathéromateux
- 6.4 - Thérapeutiques admises pour l’ensemble des patients polyvasculaires
- 6.5 - Prise en charge spécifique de certaines localisations asymptomatiques
- 6.6 - Éducation thérapeutique – compréhension de la maladie
- 6.7 - Bilan clinique annuel d’évaluation des lésions athéromateuses
- Points essentiels
-
Version PDF

-
Contenu
- Evaluations
- Annexes