- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Généralités
- 2 - La synthèse protéique
- 3 - La dégradation irréversible des acides aminés (ou catabolisme oxydatif des acides aminés, à ne pas confondre avec la protéolyse)
- 4 - La protéolyse (ou catabolisme protéique)
- 5 - Les apports en acides aminés exogènes
- 6 - Synthèse des acides aminés non essentiels
- 7 - Les moyens d’exploration du métabolisme protéique in vivo
- 8 - Régulation du métabolisme des protéines
- 9 - Besoins en azote et en acides aminés et sources protéiques alimentaires
- Version Enseignants
-
Version PDF

-
Contenu
- Annexes
- Votre Avis
- Ressources Enseignants
7 - Les moyens d’exploration du métabolisme protéique in vivo
La quantification de la masse protéique totale de l’organisme est effectuée par des méthodes de composition corporelle. À l’exception de la mesure de l’azote corporel total par activation neutronique, méthode lourde exclusivement destinée à la recherche, il n’existe pas de mesure directe de la masse protéique, qui est déduite de la mesure d’autres compartiments (masse grasse, eau corporelle).
⇒ Le bilan azoté
L’équation de base du bilan azoté est la suivante :
bilan = apport d’azote – (azote urinaire + azote fécal + autres pertes azotées)
Par définition, le bilan azoté indique l’évolution nette de la masse protéique, sous réserve que le compartiment de l’azote non protéique (c’est-à-dire le compartiment d’acides aminés libres et surtout l’urée) reste stable pendant la période de mesure. Il est positif lorsque la masse protéique s’accroît, c’est le cas en période de croissance, proche de zéro chez un adulte dont la masse protéique est constante, et négatif dans des circonstances pathologiques accompagnées d’une fonte protéique.
Bien que conceptuellement simple, le bilan azoté est de réalisation délicate si une bonne précision est recherchée. Parmi les problèmes pratiques, on peut citer :
- l’azote urinaire représente la majeure partie de l’excrétion azotée (90 % chez l’adulte), le recueil des urines doit être méticuleux. Le simple dosage d’urée urinaire (80 % de l’azote urinaire, mais cette proportion peut varier) peut être une indication suffisante en clinique mais le dosage de l’azote total doit lui être préféré quand il est possible (méthode de Kjeldhal ou pyro-chemiluminescence).
- la quantification des apports est difficile en dehors des situations de nutrition artificielle, le dosage effectif de l’azote ingéré (méthode des plateaux dupliqués) est préférable à celui de l’estimation par les tables de composition alimentaire.
- l’excrétion azotée fécale est en principe faible (10 % à 15 % des pertes azotées). Il ne faut pas oublier de prendre en compte l’excrétion azotée des fistules digestives lorsqu’elles existent.
- les pertes insensibles (sueurs, desquamations, phanères...) représentent environ 10 mg d’azote par kg par jour dans des circonstances normales.
Globalement un bilan azoté fiable doit être pratiqué sur une période minimum de 3 à 5 jours. Il s’agit donc d’un examen relativement lourd en pratique clinique. On peut lui substituer le seul dosage d’azote urinaire déjà très informatif pour le suivi d’une alimentation artificielle. Signalons enfin que compte tenu de la tendance à la surestimation des entrées et à la sous estimation des pertes, les bilans azotés sont quasi systématiquement surévalués.
⇒ La chromatographie des acides aminés
La mesure des concentrations plasmatiques en acides aminés est parfois proposée comme témoin de l’état nutritionnel. Bien que cette concentration soit abaissée au cours des malnutritions protéiques sévères, son intérêt est minime en pratique courante : les acides aminés plasma-tiques ne représentant qu’un faible pourcentage des acides aminés totaux et leur concentration dépend de l’équilibre entre synthèse, protéolyse et oxydation, ce qui la rend d’interprétation difficile. Il s’agit de plus d’un dosage assez délicat.
⇒ Les méthodes dynamiques
Ces méthodes ont en commun d’être plus invasives et de nécessiter des techniques analytiques plus lourdes, elles sont encore réservées au domaine de la recherche.
Les méthodes dynamiques locales (différences artério-veineuses)
La méthode consiste à établir un bilan des acides aminés de part et d’autre d’un organe ou d’un tissu. Chez l’homme, la méthode a été essentiellement pratiquée sur des segments de membres (avant-bras et membre inférieur) et reflète donc surtout le métabolisme protéique musculaire. Connaissant les concentrations artérielles et veineuses des différents acides aminés ainsi que le débit sanguin, on peut déduire pour chaque acide aminé un bilan net positif ou négatif selon l’état nutritionnel. L’adjonction de traceurs permet également l’accès à la synthèse et à la protéolyse musculaire. Le transport des acides aminés dans le muscle peut aussi être calculé si une biopsie est ajoutée. L’inconvénient de la méthode est d’ordre pratique puisqu’elle nécessite un cathétérisme artériel.
Les méthodes dynamiques globales
Elles donnent accès à la synthèse et à la protéolyse au niveau du corps entier ainsi qu’à l’oxydation des acides aminés. Elles nécessitent l’utilisation de traceurs qui, en France, sont exclusivement des acides aminés marqués avec des isotopes stables non radioactifs (carbone 13, deutérium ou azote 15). Ces traceurs, inoffensifs, ont l’inconvénient de nécessiter pour le dosage un spectromètre de masse, appareil complexe et coûteux.
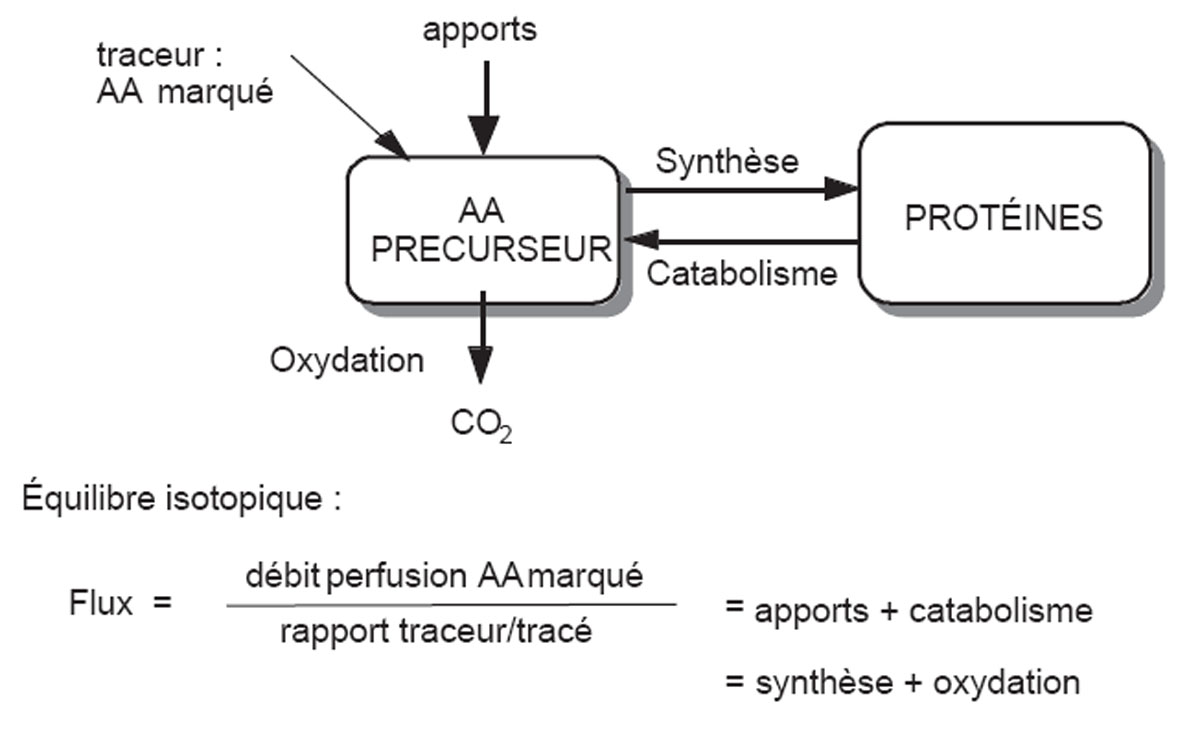
Le principe général de la méthode est celui de la dilution isotopique (Annexe I). Le débit de production d’un acide aminé est calculé en mesurant la dilution d’un acide aminé marqué introduit dans l’organisme. Le rapport de dilution (acide aminé marqué/non marqué) est inversement proportionnel au débit de production de l’acide aminé. À l’état stationnaire (concentrations stables), ce débit de production est égal au débit d’utilisation. L’ensemble production-utilisation constituant le débit de renouvellement de l’acide aminé.
La destinée de l’acide aminé peut également être quantifiée dans certaines voies métaboliques si l’on suit le traceur dans l’organisme. On mesure ainsi l’oxydation d’un acide aminé en collectant dans les gaz expirés le CO2 marqué récupéré après administration d’un acide aminé marqué au carbone 13.
La méthode la plus couramment utilisée chez l’homme est celle dite des précurseurs où l’acide aminé utilisé est la leucine. Le modèle est décrit sur la figure en annexe I. Dans cette situation, le débit de leucine issu des protéines est un index de la dégradation protéique. Le débit d’utilisation de la leucine comporte deux composantes : le flux de leucine incorporé dans les protéines, index de la synthèse protéique, et l’oxydation de la leucine. Cette oxydation de la leucine est mesurée, on en déduit par soustraction un index de la synthèse protéique.
Lors de la prise alimentaire, l’adjonction d’un traceur dans le repas permet de mesurer l’extraction splanchnique des acides aminés et de corriger la protéolyse pour la quantité d’acides aminés utilisée au niveau des tissus splanchniques (foie, intestin). Les flux d’acides aminés détournés vers la synthèse ou provenant de la protéolyse peuvent être convertis en flux de protéines sur la base d’un contenu moyen de l’acide aminé choisi dans les protéines totales de l’organisme (8 % pour la leucine et 4 % pour la phénylalanine). La représentativité de l’acide aminé vis-à-vis du métabolisme protéique « corps entier » est donc un point crucial et va déterminer le choix de cet acide aminé.
La plupart des études utilisent la leucine, acide aminé essentiel, dont la dégradation oxydative est simple, se déroule à la fois dans le foie et dans le muscle (alors que la majeure partie des autres acides aminés ont une oxydation essentiellement hépatique), et dont l’analyse en spectrométrie de masse est relativement facile.
Ce modèle largement utilisé et dont ont été dérivés les chiffres indiqués dans l’introduction pose cependant un certain nombre de problèmes :
- L’acide aminé réellement précurseur de la synthèse protéique n’est pas un acide aminé plasmatique mais un acide aminé intracellulaire et plus précisément un acide aminé lié à l’ARNt. Ce pool n’est pas accessible au prélèvement chez l’homme à moins de pratiquer des biopsies. On peut s’en approcher en mesurant le marquage non plus dans la leucine plasmatique mais dans le cétoisocaproate, produit de transamination de la leucine plus représentatif du marquage intracellulaire.
- Une mesure quantitative précise de l’oxydation de la leucine est difficile (récupération incomplète du CO2) et cette imprécision se répercute sur les estimations de synthèse protéique.
- Il s’agit de mesures au niveau du corps entier ne renseignant pas sur l’évolution du métabolisme protéique au niveau d’un tissu donné.
Les mesures de synthèse de protéines spécifiques
Après introduction d’un traceur dans l’organisme (soit par perfusion continue, soit par la méthode dite « de sur¬charge »), on peut mesurer l’incorporation du traceur au cours du temps dans la protéine considérée. En dehors de réelles difficultés analytiques, la méthode est relativement facile pour la mesure des débits de synthèse de protéines circulantes (albumine, apolipoprotéine...) mais s’avère plus difficile pour la mesure de synthèse de protéines tissulaires comme le muscle puisque l’on doit alors recourir à une biopsie. Il est également nécessaire de distinguer les différentes fractions protéiques au sein d’un tissu, c’est à dire de développer des méthodes permettant l’analyse fine de la régulation des protéines spécifiques musculaires. À partir d’une biopsie musculaire, il est possible de séparer les protéines myofibrillaires, mitochondriales et sarcoplasmiques pour mesurer leur vitesse de synthèse respective. Dans un avenir proche, des méthodes plus sophistiquées devraient permettre l’identification, la purification et la mesure de très faibles quantités de protéines pour l’étude de leur régulation et de leurs fonctions dans l’organisme. Cette nouvelle ère de recherche dont le développement est assimilable à l’étude du génome préfigure ce domaine effervescent que l’on nomme le protéome ou le métabolome.
En conclusion, le choix d’une méthode d’exploration du métabolisme protéique va essentiellement dépendre des possibilités techniques disponibles et de la question posée :
- en pratique clinique, dans le cas par exemple d’une alimentation artificielle, la méthode choisie doit être simple et rapide. On choisira de suivre, par exemple l’azote (ou l’urée) urinaire, la 3 méthyl-histidine, ou encore l’évolution des protéines de transport (cf. chapitre spécifique).
- lorsqu’un bilan protéique net à court terme (quelques jours) doit être mesuré, le bilan azoté est l’examen de choix.
- lorsqu’un bilan protéique net sur plusieurs semaines doit être évalué, c’est une estimation de masse protéique qu’il faudra pratiquer (cf. composition corporelle).
- enfin, les études portant sur la régulation de la synthèse et du protéolyse protéique nécessiteront l’utilisation de méthodes dynamiques éventuellement associées à des techniques de biologie moléculaires. Cette approche intégrative permet de préciser les mécanismes intimes à l’origine d’un gain ou d’une perte d’une ou plusieurs protéines.
Annexe 1 : Principe de dilution isotopique
7/9