- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Généralités
- 2 - La synthèse protéique
- 3 - La dégradation irréversible des acides aminés (ou catabolisme oxydatif des acides aminés, à ne pas confondre avec la protéolyse)
- 4 - La protéolyse (ou catabolisme protéique)
- 5 - Les apports en acides aminés exogènes
- 6 - Synthèse des acides aminés non essentiels
- 7 - Les moyens d’exploration du métabolisme protéique in vivo
- 8 - Régulation du métabolisme des protéines
- 9 - Besoins en azote et en acides aminés et sources protéiques alimentaires
- Version Enseignants
-
Version PDF

-
Contenu
- Annexes
- Votre Avis
- Ressources Enseignants
Points à comprendre
- Les protéines sont renouvellées en permanence par des processus biochimiques consommant de l’énergie et associant synthèse et catabolisme protéique. Le renouvellement protéique est modulé par de multiples facteurs nutritionnels et hormonaux et au cours de diverses situations pathologiques.
- Le maintien de la masse des protéines corporelles résulte de l’équilibre entre synthèse et catabolisme protéique selon un rythme dépendant des apports alimentaires. La régulation du métabolisme protéique par les hormones et les substrats énergétiques s’exerce soit sur la synthèse, soit sur le catabolisme, soit sur les deux pour promouvoir l’anabolisme ou un catabolisme protéique net.
- Les méthodes d’exploration du métabolisme protéique ont des limites qui doivent être considérées lors de leur application pour l’évaluation clinique ou la recherche fondamentale.
- Les besoins en protéines doivent être assurés par un apport suffisant à la fois en azote et en acides aminés essentiels, par l’ingestion de protéines d’origine animale et/ou végétale.
1 - Généralités
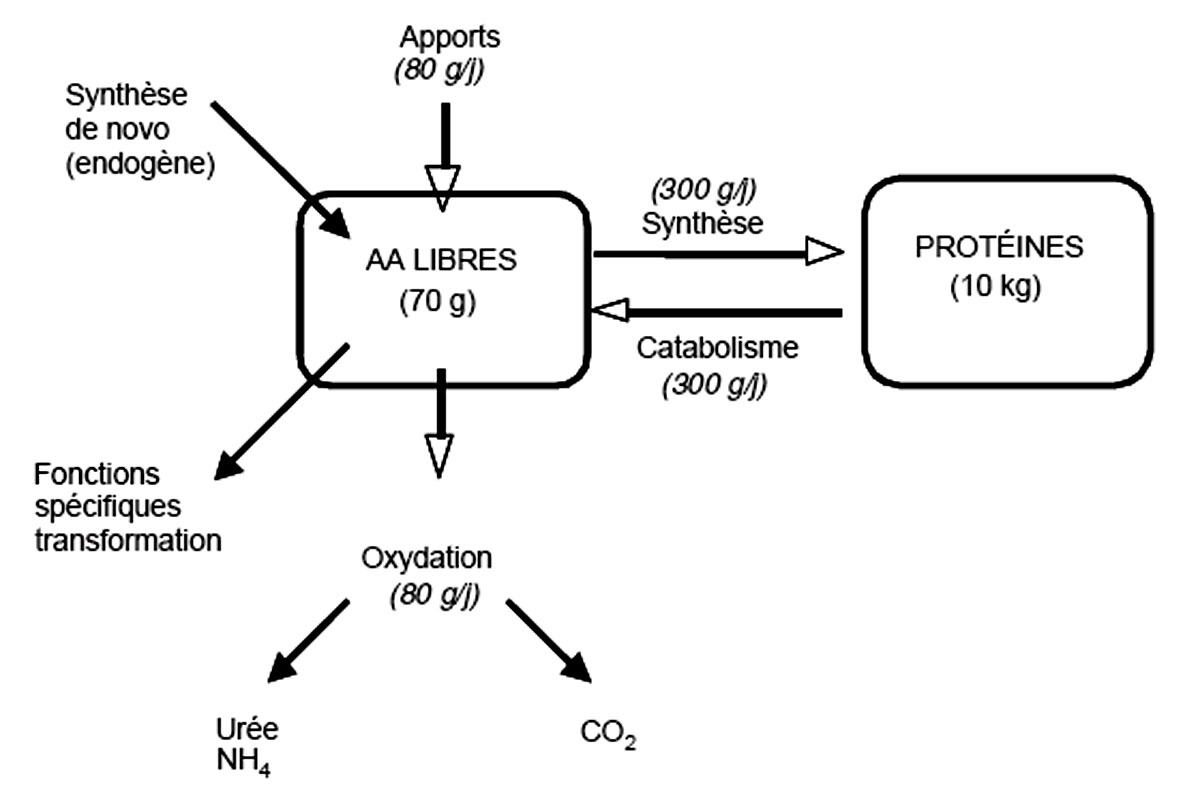
Une protéine est une molécule comportant de l’azote et composée d’une séquence d’acides aminés (au nombre de 20) reliés par des liaisons peptidiques. La séquence détermine la structure primaire de la protéine, la configuration de la chaine peptidique dans l’espace détermine les structures secondaires et tertiaires, l’association de plu¬sieurs chaînes peptidiques détermine la structure quaternaire. Par convention, une protéine comportant moins de 50 acides aminés est appelée peptide. La taille d’une protéine est extrêmement variable de quelques centaines à plusieurs millions de kilo-daltons. De même, les protéines ont de très nombreuses fonctions : protéines de structure (collagène...), protéines contractiles (myosine...), protéines de transport (albumine...), protéines immunitaires (immunoglobulines), protéines enzymatiques, hormones, récep¬teurs, etc. Malgré ces structures et fonctions très variables, toutes les protéines ont en commun une propriété, leur renouvellement permanent schématisé sur la figure 1.
1. Schéma général du métabolisme protéique chez l’homme
⇒ Paramètres cinétiques du métabolisme protéique
Les principales voies de production et d’utilisation des acides aminés et des protéines sont indiquées sur le schéma et les chiffres indiqués à titre indicatif correspondent approximativement aux valeurs observées chez l’adulte en bonne santé :
- la synthèse protéique : elle se fait à partir d’un pool (compartiment) d’acides aminés libres de très petite taille, environ 70 g (soit moins de 1 % des acides aminés de l’organisme) lui-même compartimenté en 2 pools extra-cellulaire et intracellulaire, ce dernier représentant environ 95 % des acides aminés libres et étant le véritable précurseur de la synthèse,
- la protéolyse (ou dégradation protéique) libérant des acides aminés dans le pool,
- ces deux phénomènes de synthèse protéique et de protéolyse sont simultanés et constituent le renouvellement (turnover) protéique. L’équilibre entre synthèse et protéolyse est responsable de la conservation de la masse protéique. Une synthèse supérieure à la protéolyse résulte en un gain protéique net (ou accrétion protéique) improprement appelé anabolisme protéique. A contrario, une protéolyse supérieure à la synthèse résultera en une diminution de la masse protéique,
- la dégradation irréversible des acides aminés correspond à l’oxydation de ces derniers et résulte en une production d’azote et de CO2,
- les apports protéiques compensent les pertes d’acides aminés, la différence entre apports et pertes constituant le bilan protéique (ou bilan azoté) et correspondant également à la différence entre synthèse et protéolyse protéique à condition que la taille du pool d’acides aminés libres ne varie pas, ce qui est le cas la plupart du temps.
⇒
Renouvellement des protéines
Il existe plusieurs dizaines de milliers de protéines, différentes dans leurs structures et leurs fonctions chez les mammifères.
Ces protéines participent de façon très variable au renouvellement protéique global en fonction de :
- l’importance quantitative de la protéine considérée et à ce titre les organes les plus importants sont le muscle, l’intestin, le foie et la peau,
- la rapidité du renouvellement de chaque protéine considérée individuellement. Cette rapidité est très variable, pratiquement nulle pour certaines protéines du cristallin, très importante pour certaines protéiques hépatiques exportées (à titre d’exemple, la totalité du stock corporel d’apolipoprotéines B100 des VLDL est renouvelée 3 fois par jour).
Ainsi, le renouvellement des protéines musculaires représente environ 20 % du renouvellement protéique total, celui du foie environ 10 % (la masse hépatique est très inférieure à la masse musculaire mais ses protéines sont renouvelées beaucoup plus rapidement), les protéines de la peau et du tube digestif constituant les deux autres participants importants (environ 15 % chacun). Ces pourcentages indicatifs varient en fonction de l’âge, et probablement de l’espèce. D’un point de vue nutritionnel, il est habituel de considérer l’ensemble du métabolisme protéique selon ce schéma général dont le caractère très (trop) global doit cependant être gardé en mémoire.
Les valeurs de renouvellement indiquées sur le schéma correspondent à celles observées chez un adulte de 70 kg en bon état nutritionnel. Il est habituel d’exprimer la synthèse protéique et la protéolyse par kg de poids corporel, ce qui correspond à environ 4 g de protéine synthétisée et dégradée par kg de poids et par jour. En l’absence de croissance, la masse protéique reste stable et la synthèse est donc égale à la protéolyse sur une période de 24 h.
⇒
Les variations du renouvellement protéique
Elles sont importantes en fonction de l’état physiologique et de différents états pathologiques :
- selon l’âge : le renouvellement protéique est beaucoup plus rapide chez le nouveau-né (10 à 15 g/kg/jour), la synthèse étant supérieure à la protéolyse, ce qui résulte en un gain protéique 1 à 1,5 g de protéine/kg/jour (correspondant à un gain pondéral de 20 à 30 g/jour composé de 12 % de protéines). Chez le sujet âgé, le renouvellement protéique semble ralenti mais est habituellement normal si la réduction de masse maigre est considérée.
- selon l’état nutritionnel : le renouvellement protéique diminue au cours du jeûne, la protéolyse restant supérieure à la synthèse protéique, ce qui induit un bilan protéique négatif
- selon l’état pathologique : en règle générale les situations dites cataboliques, comme un syndrome inflammatoire, un traumatisme ou un sepsis, entraînent une augmentation importante du renouvellement protéique qui peut être multiplié par 3 à 4, la protéolyse étant cependant supérieure à la synthèse protéique et résultant en des pertes protéiques massives avec réduction de la masse protéique musculaire.
Au total, ces trois situations soulignent la possible dissociation entre un gain protéique d’une part (résultat entre synthèse et catabolisme) et une synthèse protéique d’autre part : une synthèse protéique élevée (comme chez le patient brûlé ou traumatisé) n’est pas forcément associée à un gain protéique (en raison d’une protéolyse accrue). Enfin, les différentes variations constatées au niveau du métabolisme protéique du corps entier ne portent pas de façon similaire sur le métabolisme des différents compartiments protéiques : ainsi au cours des situations cataboliques, l’accélération du renouvellement protéique hépatique participe de façon majoritaire à l’accélération du renouvellement protéique global (synthèse de protéines inflammatoires), le muscle devenant un organe majoritairement producteur d’acides aminés (stimulation de la protéolyse musculaire).
⇒ Quelle est la finalité du renouvellement protéique ?
L’existence d’un renouvellement protéique relativement rapide permet une meilleure adaptation aux différentes circonstances nutritionnelles et physiopathologiques. Il permet également l’élimination de protéines vieillies ne pouvant plus remplir leurs fonctions physiologiques de façon satisfaisante. Enfin, son rôle dans la reconnaissance immunitaire par la génération de peptides est important. Par rapport à la figure du schéma général, nous considérerons le pool d’acides aminés libres comme élément central du métabolisme protéique et envisagerons successivement les voies d’utilisation des acides aminés et les voies de production de ces acides aminés. Le métabolisme de chaque acide aminé ne sera pas considéré individuellement (bien que quelques exemples soient donnés) mais en relation avec le métabolisme protéique vu sous un angle nutritionnel.
1/9