Cours
3.3.2.4. Facteurs de virulence de Porphyromonas gingivalis
P. gingivalis est considéré comme un des pathogènes majeurs des parodontites agressives généralisées et chroniques sévères : il est très fréquemment isolé, et en grand nombre, des lésions actives, et l'infection s'accompagne d'une notable augmentation du taux d'anticorps spécifiques.
Les nombreux facteurs de virulence dont dispose cette bactérie lui confèrent un potentiel pathogène supérieur à celui des autres BPN.
Les fimbriae
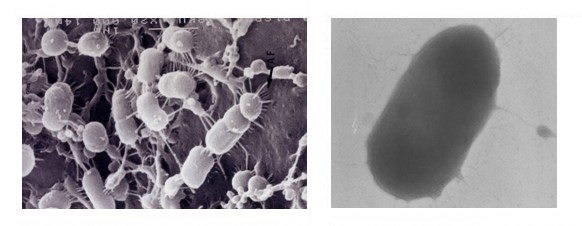
Des structures et des molécules de surface confèrent à la bactérie ses propriétés d'adhérence. La plupart des souches de cette bactérie présentent des fimbriae réparties de façon péritriche, les unes sont longues et fines (fimbriae majeures), les autres sont courtes (fimbriae mineures). Le monomère des fimbriae majeures, ou fimbriline ou FimA, est une protéine de 43kDa. 6 types de FimA ont été identifiés, et il semblerait que la virulence de P. gingivalis soit influencée par le type de fimbriae exprimé.
Les adhésines participent à la formation des biofilms dentaires. Elles permettent l’adhésion de la bactérie à des composants salivaires, la coagrégation avec différents genres bactériens (Actinomyces, Streptococcus, Fusobacterium, Treponema). Elles adhèrent également aux cellules procaryotes, à diverses molécules de la matrice extracellulaire et à d’autres molécules.
Les fimbriae sont immunogéniques.
Fixation de P. gingivalis par ses fimbriae sur les cellules épithéliales
Les hémagglutinines
Cinq hémagglutinines ont été identifiées, et permettent la fixation à l’hème des érythrocytes. L’hémagglutinine Hag A paraît plus particulièrement impliquée.
La capsule
Elle forme chez P. gingivalis une couche extracellulaire moins dense que chez les autres BPN. Elle confère un caractère hydrophile à la surface de la bactérie, ce qui lui permet sans doute de résister à la phagocytose.
Les vésicules
Les cellules de P. gingivalis forment des extensions de la membrane externe, relâchées en grande quantité dans le milieu extérieur sous forme de vésicules. Elles sont environ 10 fois plus petites que la bactérie dont elles sont issues, et souvent émises en très grand nombre.
Provenant de la membrane externe, les vésicules renferment donc tous les constituants de cette dernière. Elles peuvent servir de vecteur aux activités protéolytiques, toxiques et antigéniques.
Les enzymes
Un vaste répertoire enzymatique, en particulier protéolytique, confère à P. gingivalis un remarquable pouvoir pathogène.
Une activité protéolytique de P. gingivalis a été démontrée sur les substrats protéiques suivants : caséine, collagène, complément, fibronectine, immunoglobulines, lysozyme. Les protéinases et peptidases qui en sont responsables permettent à cette bactérie asaccharolytique non seulement de puiser son énergie dans des nutriments protéiques, mais aussi d'exercer un effet destructeur sur les tissus et d'inactiver des molécules de protection mises en place par le système immunitaire.
Deux activités enzymatiques que ne possède pas P. gingivalis sont la ß-lactamase et l'élastase.
P. gingivalis est le seul BPN qui possède une collagénase spécifique, active sur les collagènes de type I, II, III et IV ; l'activité collagénolytique des autres BPN est le fait de protéinases non spécifiques.
Bactéries dans le tissu conjonctif
La forte activité pseudo-trypsine de P. gingivalis lui permet la dégradation de nombreuses protéines comme l'albumine, la gélatine, la caséine.
Les toxines
Les acides gras produits par P. gingivalis, en particulier le butyrate et le propionate, sont des agents cytotoxiques P. gingivalis produit de grandes quantités de composés sulfurés qui contribuent à accroître la perméabilité de la muqueuse buccale.
La partie lipidique (lipide A) du LPS de P. gingivalis fait preuve d'une activité endotoxinique peu marquée ; cependant le LPS de P. gingivalis possède de nombreuses activités biologiques, lui conférant un rôle important dans la pathogénèse de la lésion parodontale.
L'inactivation des défenses immunitaires de l'hôte
Elle est aussi le fait de l'arsenal enzymatique de P. gingivalis. Des immunoglobulines protéases lui permettent d'hydrolyser les IgG, IgM et IgA en peptides, utilisés comme nutriments. Des protéases actives sur C3, C4 et C5 lui permettent d'inactiver le complément.
De cet ensemble de propriétés propres à P. gingivalis résulterait une paralysie locale du système de défense humoral et de la phagocytose, propice à une invasion par les bactéries parodontopathogènes et les substances qu'elles élaborent.
P. gingivalis se révèle, de plus, pourvu d'enzymes protéolytiques qui inactivent certaines des protéines anti-inflammatoires du plasma humain connues sous le nom générique d'inhibiteurs de protéases. L'inactivation ou la dégradation de ces molécules anti-inflammatoires permet vraisemblablement un entretien du processus inflammatoire local.