- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Préambule
- 2 - Adaptation à la vie extra-utérine
-
3 - Reanimation en salle de naissance
- 3.1 - Anticipation
- 3.2 - Objectifs et principes de la réanimation néonatale
- 3.3 - Diagramme de réanimation
- 3.4 - Techniques de réanimation
- 3.5 - Surveillance et stabilisation
- 3.6 - Arret de reanimation
- 4 - Cas particuliers
- 5 - Bibliographie
-
Version PDF

-
Contenu
- Annexes
2 - Adaptation à la vie extra-utérine
La prise en charge des nouveau-nés en salle de naissance nécessite une bonne connaissance des phénomènes d’adaptation à la vie extra-utérine tant sur le plan cardio respiratoire que métabolique.
 L'adaptation à la vie extra-utérine
L'adaptation à la vie extra-utérine
2 . 1 - Adaptation respiratoire
La transition de la vie fœtale à la vie extra utérine est caractérisée sur le plan respiratoire par le passage des poumons d’un milieu liquide à un milieu aérien.
2 . 1 . 1 - In utero
L’appareil respiratoire est fonctionnel assez tôt pour permettre la survie des enfants très prématurés mais son développement se poursuit bien après la naissance. Des mouvements du thorax de faible amplitude sont observés dès 12-15 SA, d’abord continus, ils deviennent intermittent vers 37-38 SA.
L’arbre aérien est rempli d’un liquide sécrété par les cellules alvéolaires : le liquide pulmonaire, dont la composition est proche de celle du liquide amniotique. Cette sécrétion est d’environ 250 ml/24h à terme et le volume total de liquide dans les poumons est d’environ 30ml/kg en fin de grossesse. Il joue un rôle facilitant dans l’ouverture des alvéoles pulmonaires, même si sa production diminue dans les 2-3 jours qui précèdent la naissance sous l’action de phénomènes encore mal définis.
Le surfactant est un complexe lipoprotéique à l’action tensio-active et anti œdémateuse. Il est sécrété par les pneumocytes de type II de la paroi des alvéoles à partir de 20-22 SA mais sa production reste faible et sa composition évolue jusque vers 35-36SA.
La maturation biochimique du poumon est régulée par un contrôle endocrinien multifactoriel dans lequel les androgènes jouent un rôle freinateur. On observe donc une maturation pulmonaire plus précoce chez les fœtus de sexe féminin. [6-7-8]
2 . 1 . 2 - A la naissance
Les mouvements respiratoires deviennent réguliers et efficaces dès le dégagement du thorax, dans les secondes qui suivent l’expulsion.
Les premières inspirations provoquent l’ouverture des alvéoles pulmonaires et créent une variation de pression de - 40 à + 80 cm d’H2O dans les poumons pouvant entrainer une rupture alvéolaire spontanée ou un pneumothorax alors qualifié d’idiopathique. [6-7]
Le déplissement alvéolaire est accompagné d’un déversement massif de surfactant dans les voies respiratoires. Il en résulte la création et la stabilisation d’une capacité résiduelle fonctionnelle (CRF) d’environ 30 ml/kg, correspondant au volume de liquide pulmonaire in utero.
Le volume courant lui est alors d’environ 6ml/kg.
La sécrétion du liquide pulmonaire commence à diminuer avant la mise en travail sous l’action de l’adrénaline, et son arrêt devient effectif dans les 30 minutes qui suivent la naissance.
Le liquide pulmonaire est évacué des voies aériennes par un double mécanisme :
- La compression du thorax lors du passage dans la filière génitale maternelle. (<1/3 du volume)
- La résorption veineuse et lymphatique pulmonaire dans les 4 à 6 premières heures de vie. (>2/3 du volume)
L’expansion physique des poumons et l’augmentation de la pression partielle en oxygène dans les alvéoles, entrainent l’effondrement des résistances vasculaires pulmonaires et l’augmentation du débit sanguin pulmonaire. Après des efforts respiratoires initiaux, le nouveau-né doit être capable d’établir une respiration régulière et suffisante pour maintenir sa fréquence cardiaque au dessus de 100 bpm et améliorer sa coloration. [6-7]
2 . 2 - Adaptation circulatoire
2 . 2 . 1 - In utero
In utéro, l’oxygénation du fœtus est assurée par le placenta et non par les poumons. La circulation pulmonaire ne représente donc que 20% du débit cardiaque total et a pour seule fonction, le développement des poumons. La circulation fœtale est organisée de façon à privilégier la circulation systémique à la circulation pulmonaire en assurant un maximum de débit au niveau du placenta.
Elle se caractérise donc par l’existence de deux circuits parallèles :
- un pulmonaire, aux résistances vasculaires élevées,
- un systémique, aux résistances vasculaires basses,
communicant par 3 shunts physiologiques droite-gauche.
- 1er shunt : le Canal d’Arantius ou Ductus Venosus, situé au niveau du foie, met en communication la veine ombilicale (VO) et la veine cave inférieure (VCI) permettant ainsi au sang enrichi en oxygène par le placenta de rejoindre la circulation générale avant de remonter vers l’oreillette droite (OD).
- 2ème shunt : le Foramen Ovale (FO) ou trou de Botal, situé entre les deux oreillettes, permet au sang de l’oreillette droite d’être prioritairement dirigé dans l’oreillette gauche (OG) puis le ventricule gauche (VG) et la circulation générale en « court-circuitant » les poumons.
- 3ème shunt : le Canal Artériel (CA) ou Ductus Artériosus met en communication les artères pulmonaires (AP) et l’aorte (Ao) redirigeant une partie de la circulation pulmonaire vers la circulation générale. [7]
Durant son trajet du placenta vers les différents organes, le sang oxygéné s’appauvrit en oxygène ce qui explique l’hypoxémieDéfinitiondiminution de la quantité d'oxygène transportée par le sang. La pression partielle en O2 diminue synonyme de mauvais échanges entre les alvéoles pulmonaires et les capillaires sanguins. relative du fœtus in utéro. La saturation maximum en oxygène (SaO2) au niveau de la VCI ne dépassant pas 70%.
Figure 1 : circulation foetale
Figure 2 : circulation adulte
Source : UVMaF
2 . 2 . 2 - A la naissance
Avec le premier cri, les résistances vasculaires pulmonaires s’effondrent et la circulation pulmonaire se met en place. L’augmentation du retour veineux pulmonaire dans l’oreillette gauche provoque une augmentation des pressions au niveau des cavités gauches du cœur (OG-VG-Ao) tandis que l’interruption de la circulation ombilicale au clampage du cordon fait chuter les pressions au niveau du cœur droit (OD-VD-AP). [6-9-10]
Les pressions de la circulation systémique deviennent alors supérieures à celles de la circulation pulmonaire entrainant une augmentation du débit sanguin pulmonaire.
Les shunts changent de sens, ils deviennent gauche-droite et conduisent à la fermeture fonctionnelle du foramen ovale. Ces modifications de pressions induisent dans les 4 à 12h de vie, une vasoconstriction qui provoque la fermeture du canal artériel. [7]
La fermeture des shunts n’est pas définitive avant plusieurs jours, ce qui explique une certaine instabilité circulatoire rendant le nouveau-né particulièrement sensible aux variations hémodynamiques en période néonataleDéfinition28 premiers jours de vie.
L'hypoxémie comme l’acidose, entraine une vasoconstriction pulmonaire qui conduit à la persistance ou au retour à une circulation sanguine type fœtale à faible débit pulmonaire. Cette absence d’adaptation des résistances vasculaires pulmonaires favorise l’apparition d’une hypertension artérielle pulmonaire (HTAP) avec persistance comme dans la vie fœtale des shunts droite-gauche.
2 . 3 - Thermorégulation
2 . 3 . 1 - In utero
In utero, le principal problème du fœtus est la dissipation de la chaleur.
La thermogénèse est minime, inhibée par le manque relatif d’oxygène et l’utérus maintient le fœtus à une température supérieure de 0.3 à 0.8 °C à celle de sa mère. [6-7-8]
Une élévation de la température maternelle est toujours mal supportée par le fœtus provoquant une tachycardie fœtale plus ou moins associée à des ralentissements du RCF.
2 . 3 . 2 - A la naissance
A la naissance, le nouveau-né doit à la fois produire sa propre chaleur mais également lutter contre le refroidissement pour maintenir sa température dans la zone de neutralité thermique qui se situe aux alentours de 32°C s’il est né à terme ou de 35°C s’il est prématuré.
Le principal mécanisme de production de chaleur est la thermogénèse sans frisson, c’est à dire la production de chaleur à partir du tissu adipeux brun mis en place au 3ème trimestre de la grossesse.
Le système de régulation thermique hypothalamique est fonctionnel dès la naissance, cependant, il peut être altéré par l’asphyxie périnatale ou les drogues maternelles (morphinique, anesthésique, anxiolytiques…) et rend alors le nouveau-né particulièrement sensible aux variations de températures extérieures. [6-8]
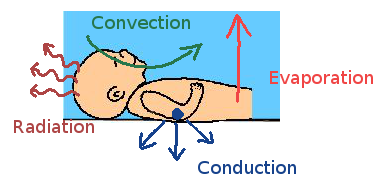
Il existe 4 mécanismes de déperdition de chaleur :
- La conduction : lorsque l’on pose l’enfant sur une surface froide.
- La convection : lorsque l’air ambiant est plus froid
- La radiation : lorsque la chaleur se diffuse de l’enfant vers les objets froids.
- L’évaporation : lorsque l’enfant reste humide.
La tête représente 20% de la surface corporelle et contribue à 50% des pertes de chaleur.
La principale cause de déperdition est l’évaporation à raison de 0.1°C / min.
Les pertes par convection augmentent avec l’importance des courants d’air. [6]
La température du nouveau-né peut rapidement passer de 37°C à 33°C si la température ambiante est de 22 -24°C et son métabolisme de base est multiplié par 3 quand la température se situe entre 25 et 28°C. L’hypothermie augmente la consommation d’oxygène et peut compromettre la réanimation en aggravant la détresse respiratoire, l’hypoglycémie et l’acidose. [8-10]
2 . 4 - Régulation glycémique
2 . 4 . 1 - In utero
Le glucose diffuse à travers le placenta, de la mère vers le fœtus.
La néo glycogénèse est quasiment inexistante chez le fœtus. [7]
La glycémie fœtale correspond à 70-80% de la glycémie maternelle et s’abaisse rapidement en cas de jeûne maternel par diminution de la diffusion placentaire du glucose de 40%.
L’insuline maternelle ne passe pas la barrière placentaire, le fœtus assure donc sa propre production dès 10-12 SA en rapport direct avec les variations de sa glycémie. [6]
Toute situation de « stress » ou d’hypoxieDéfinitiondiminution de la concentration en O2 dans le sang suffisante pour entrainer des signes et symptômes d'une oxygénation inadéquate des tissus, sous l’action des catécholamines et notamment de l’adrénaline, diminue la sécrétion d’insuline, augmente celle du glucagon et stimule la glycogénolyse.
2 . 4 . 2 - A la naissance
Au clampage du cordon le nouveau-né doit subvenir seul à ses besoins.
La glycémie chute durant la 1ère heure de vie pour atteindre un minimum dont la valeur est directement liée à la quantité de glucose reçue par la mère pendant le travail et l’accouchement. [6]
Secondairement, la sécrétion de glucagon augmente et celle d’insuline diminue entrainant une augmentation de la glycémie du nouveau-né aux alentours de 2.2 - 2.4 mmol/l par mobilisation de ses réserves de glycogène. [7]
2 . 5 - Définition et physiopathologie de l’asphyxie périnatale
2 . 5 . 1 - In utero
L’asphyxie per-partum est le résultat d’une altération sévère et durable des échanges gazeux entre la mère et l’enfant, conduisant à une acidose métabolique (augmentation de la production de lactates par altération du métabolisme cellulaire).
L’oxygène du sang maternel traverse le placenta par un processus de diffusion.
Ce transfert est facilité par un taux d’hémoglobine fœtale supérieur à celui de la mère et une plus grande affinité de cette hémoglobine pour l’oxygène.
L’oxygène circule dans le sang fœtal comme dans le sang maternel sous deux formes :
- une forme dissoute qui sert à l’oxygénation des tissus et se mesure par la pression partielle en oxygène du sang (pO2) exprimée en millimètre de mercure (mm Hg) ;
- une forme libre de l’hémoglobine des globules rouges qui sert de réserve d’oxygène, libérée dans le sang en cas de diminution de la pO2. Elle est quantifiée par la saturation en oxygène du sang (SaO2) et s’exprime en %.
En cas d’altération des échanges materno-fœtaux, l’hypoxémie qui correspond à la diminution de la pO2 artérielle est le premier phénomène que l’on observe. Le fœtus s’adapte à cette situation en augmentant l’extraction placentaire d’oxygène et en diminuant son activité métabolique pour ne préserver que son métabolisme énergétique.
Lorsque l’hypoxémie se prolonge, l’oxygène tissulaire diminue, c’est l’hypoxie. Le fœtus peut encore compenser cette situation grâce à la libération de catécholamines qui provoquent une vasoconstriction périphérique assurant une redistribution du sang vers le cœur et le cerveau. Le métabolisme des tissus périphériques devient alors anaérobie et la production d’acide lactique engendre une acidose métabolique fœtale.
Lorsque cette acidose n’est plus compensée, c’est l’état d’asphyxie. La redistribution du flux sanguin vers le cerveau et le cœur disparaît et l’on voit apparaitre des lésions neurologiques, une défaillance multi viscérale et le décès si le fœtus n’est pas extrait. [16]
2 . 5 . 2 - A la naissance
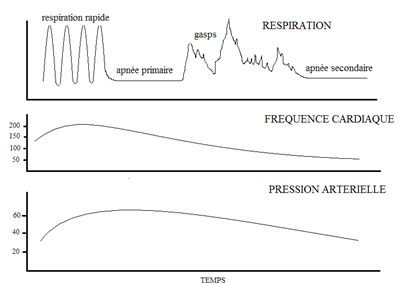
L’existence de mouvements respiratoires ne peut être utilisée comme seul indicateur d’efficacité de la respiration, car l’asphyxie peut avoir débuté in utero et se poursuivre après la naissance.
Elle est responsable d’une mauvaise adaptation respiratoire et déclenche une séquence d’évènements bien définie.
La respiration est d’abord rapide puis les mouvements respiratoires s’arrêtent.
Cette apnée primaire entraîne une diminution de la fréquence cardiaque.
A ce stade, des stimulations tactiles et l’administration d’oxygène suffisent le plus souvent à déclencher des mouvements respiratoires.
Si l’état d’asphyxie se poursuit, des gasps profonds apparaissent.
La fréquence cardiaque continue de diminuer et la pression artérielle commence à baisser.
Les mouvements respiratoires deviennent superficiels puis laissent place à une apnée secondaire.
Une ventilation en pression positive est alors indispensable pour assurer sa survie de l’enfant.
Dans cet état, plus le délai de mise en route de l’assistance respiratoire est long, plus l’établissement de mouvements respiratoires spontanés sera difficile et le risque de dommages cérébraux important.
L’apnée primaire et l’apnée secondaire sont pratiquement impossibles à distinguer l’une de l’autre à un moment donné. Une apnée à la naissance doit donc être traitée comme s’il s’agissait d’une apnée secondaire. La « réanimation respiratoire » doit être rapidement entreprise, si les stimulations de l’enfant s’avèrent inefficaces.
Les marqueurs biologiques d’asphyxie ont une faible valeur pronostique au niveau individuel, tout comme les marqueurs cliniques (score d’Apgar bas, liquide amniotique méconial). Toutefois, ils sont indispensables à recueillir pour argumenter une relation de cause à effet entre l’asphyxie périnatale et la ou les pathologies néonatales retrouvées.
2/11


.jpg)
.jpg)