4 - Diagnostic biologique
4 . 1 - Chez l'immunocompétent
Un syndrome mononucléosique et un syndrome inflammatoire (augmentation de la CRP) sont habituels mais non spécifiques.
Le code de nomenclature des actes de biologie médicale (arrêté du 3 avril 1985 modifié) impose la recherche d'anticorps de type IgG et IgM pour le diagnostic sérologique de la toxoplasmose.
Pour les IgG, la technique de référence reste le dye test (coloration vitale) ou test de lyse, dont la difficulté limite la réalisation à quelques laboratoires spécialisés. En routine, les techniques les plus utilisées sont les méthodes immunoenzymatiques dont l'ELISA, l'immunofluorescence indirecte (IFI) et l'agglutination sensibilisée. Le résultat est exprimé en unités internationales par millilitre (UI/mL).
Pour les IgM, la détection repose essentiellement sur des méthodes d'immunocapture : ELISA, ISAGA ; cette dernière technique est la plus sensible. Le résultat est exprimé sous la forme d'un index.
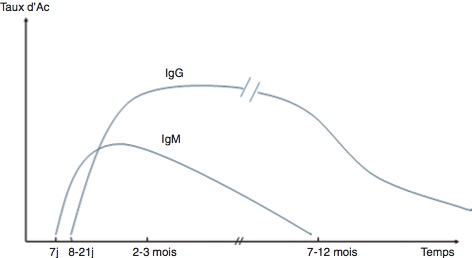
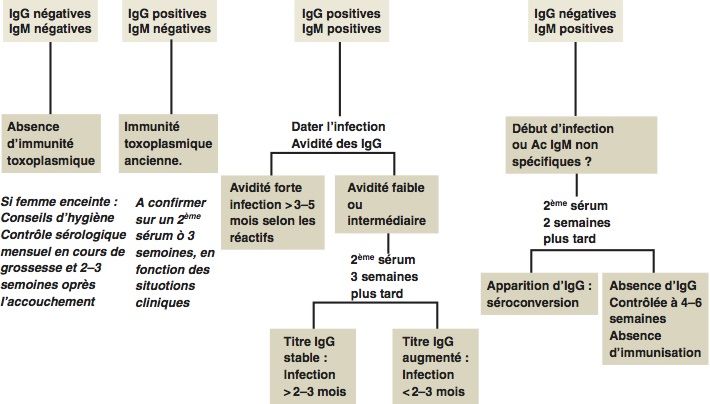
Classiquement, les IgM apparaissent les premières, à la fin de la première semaine suivant la contamination, et sont détectées 7 à 12 mois en moyenne avec les techniques actuelles ; la présence d'anticorps de classe IgM ne permet pas d'affirmer une toxoplasmose évolutive. Les IgG apparaissent habituellement à partir du 8e jour (leur délai d'apparition peut parfois atteindre 5 à 6 semaines) et s'élèvent progressivement pour atteindre un plateau à partir du 2e ou 3e mois. Les titres diminuent ensuite lentement. Les IgG persistent toute la vie à un taux résiduel (figure 6.10). La connaissance de cette cinétique permet l'interprétation du statut sérologique (figure 6.11). Le diagnostic de toxoplasmose évolutive nécessite l'étude de deux sérums espacés de 15 à 20 jours mettant en évidence soit une séroconversion (premier sérum négatif, second sérum positif) soit la présence d'IgM associée à une élévation significative du titre des IgG entre le premier sérum et le second sérum titrés en parallèle. Pour être significative, une élévation du titre des IgG implique au moins deux dilutions (de raison 2) d'écart avec les méthodes par dilution (IFI, par exemple) ; en ELISA, l'élévation à considérer comme significative varie selon les trousses mais un doublement du titre est le minimum à considérer. Un travail plus fin sur les IgG (détermination du coefficient d'avidité) ou le recours à la recherche des IgA spécifiques permettent le plus souvent de faire la distinction entre une infection récente ou ancienne.
Chez la femme enceinte, il convient de confirmer rapidement une infection acquise en cours de grossesse par un contrôle sérologique rapproché (15 jours) — apparition ou augmentation d'IgG en présence d'IgM — et d'instaurer le traitement par spiramycine dès la confirmation (figure 6.11).
Pour des raisons liées à l'absence de standardisation des réactifs, le résultat écrit doit mentionner le réactif utilisé et les valeurs seuils. Le biologiste doit de plus rédiger une conclusion argumentée. Aucune conclusion correcte ne peut être tirée de la comparaison de deux résultats de sérologie de la toxoplasmose qui n'auraient pas été effectués en parallèle dans le même laboratoire et par la même technique.
4 . 2 - Chez l'immunodéprimé
Chez les patients réactivant une toxoplasmose ancienne, la sérologie ne permet jamais d'affirmer que l'épisode clinique aigu est bien en rapport avec la toxoplasmose ; elle permet seulement d'envisager le diagnostic comme possible et c'est la recherche du parasite — ou l'efficacité du traitement d'épreuve, justifié devant un tableau d'abcès cérébral avec une imagerie évocatrice — qui confirme le diagnostic. La recherche du toxoplasme peut être faite par coloration, marquage avec des anticorps monoclonaux, inoculation à l'animal ou PCR à partir de n'importe quel prélèvement biologique (lavage bronchiolo-alvéolaire, liquide cérébrospinal, sang périphérique, moelle…).
Dans les cas de primo-infection, la sérologie reste contributive, avec toutefois un possible retard d'apparition des anticorps en rapport avec les traitements immunosuppresseurs (en particulier chez les patients allogreffés de cellules souches hématopoïétiques), ce qui justifie la recherche directe en cas de signe clinique évocateur.
Chez les patients greffés d'organe solide séropositifs pour le toxoplasme en prégreffe, une réactivation sérologique portant sur les IgG est possible en postgreffe, parfois accompagnée de la réapparition des autres isotypes (IgM, IgA), mais le plus souvent sans conséquence clinique.
4 . 3 - Diagnostic biologique de la toxoplasmose congénitale
4 . 3 . 1 - Diagnostic anténatal
Il n'est pas justifié de proposer systématiquement l'interruption de la grossesse à une femme enceinte faisant une séroconversion toxoplasmique dans la mesure où la majorité des enfants issus de ces grossesses sont indemnes (globalement 70 %). La prise en charge correcte de ces séroconversions nécessite d'établir le diagnostic de l'infection fœtale. Le diagnostic anténatal repose sur la surveillance échographique et l'amniocentèse. L'échographie ne permettant que la visualisation d'anomalies déjà constituées, c'est l'amniocentèse avec la détection dans le liquide amniotique du parasite par PCR et parfois par inoculation à la souris qui permet de confirmer l'atteinte fœtale ; ces examens doivent être réalisés dans un laboratoire agréé. On recommande un délai de 1 mois minimum entre la contamination maternelle et la date de la ponction (délai placentaire nécessaire au passage du parasite de la mère vers l'enfant), qui n'est faite au plus tôt qu'à partir de la 18e semaine d'aménorrhée. La positivité de la PCR et/ou de l'inoculation à la souris permet d'affirmer le diagnostic de toxoplasmose congénitale. En revanche, un résultat négatif n'exclut pas l'atteinte fœtale, les données bibliographiques faisant état d'environ 10 % de faux négatifs, essentiellement en cas de séroconversion survenue au premier ou au troisième trimestre de la grossesse.
4 . 3 . 2 - Diagnostic néonatal et suivi sérologique ultérieur de l'enfant
Les moyens biologiques du diagnostic néonatal doivent être mis en route pour tous les nouveau-nés dont les mères ont une suspicion d'infection toxoplasmique en cours de grossesse, avec un diagnostic anténatal négatif ou non pratiqué. Ces moyens associent la recherche du parasite et la sérologie. Ils sont associés à un bilan clinique comportant la réalisation d'un fond d'œil et d'une échographie transfontanellaire.
La recherche du parasite est toujours pratiquée de façon indirecte, par inoculation à la souris ou PCR. Les produits biologiques étudiés sont le placenta, le sang de cordon, parfois le sang du nouveau-né. La sérologie de l'enfant dans le sang du cordon n'est pas vraiment contributive car la détection d'IgM ou d'IgA peut être due à une effraction de sang maternel vers l'enfant lors de l'accouchement. Sur le sang prélevé à quelques jours de vie, la présence d'IgM ou d'IgA spécifiques permet d'affirmer la toxoplasmose congénitale, car ces isotypes d'immunoglobulines ne franchissent pas la barrière placentaire et les IgM maternelles contaminant éventuellement le sang du cordon disparaissent très rapidement chez l'enfant non infecté. À l'inverse, l'absence de ces isotypes ne permet en aucun cas de récuser le diagnostic ; en effet, 30 % à 50 % des enfants infectés ne présentent pas d'IgM, et 20 % à 30 % n'ont ni IgM ni IgA. Les IgG franchissent la barrière placentaire. Chez l'enfant, il faudra donc évaluer la part d'anticorps IgG synthétisés par l'enfant en réponse à une infection congénitale et celle d'anticorps IgG transmis par la mère. Le profil immunologique comparé mère/enfant par immunoempreinte (western blot) ou technique assimilée permet de mettre en évidence les anticorps IgG ou IgM propres à l'enfant.
Si le diagnostic n'est pas porté à la naissance, l'organisation du suivi sérologique est la suivante : contrôles sérologiques à M1, M2, M3. Cette procédure permet de diagnostiquer 94 % des toxoplasmoses congénitales au cours des trois premiers mois. Les sérologies prélevées ensuite à M4, M6, M9 et M12 confirment les cas restants sur la persistance des IgG.
Pour affirmer l'absence de toxoplasmose congénitale, la surveillance sérologique doit être poursuivie jusqu'à disparition complète des anticorps IgG transmis par la mère en l'absence de traitement antitoxoplasmique.
4 . 4 - Diagnostic biologique de la toxoplasmose oculaire
La suspicion de diagnostic de toxoplasmose oculaire est principalement ophtalmologique. En cas de doute, des arguments en faveur du diagnostic peuvent être apportés par l'étude de l'humeur aqueuse après ponction de la chambre antérieure. Les techniques utilisées sont la PCR et la sérologie, avec la recherche d'une synthèse locale d'anticorps objectivée par le calcul du coefficient de charge immunitaire, ou coefficient de Desmonts ou de Goldmann-Witmer, et le profil immunologique comparé sérum/humeur aqueuse par western blot. La positivité de ces examens est un bon argument pour le diagnostic de toxoplasmose oculaire ; leur négativité ne permet pas de le récuser formellement. La PCR et le profil immunologique comparé sont également réalisables sur le vitré.
5 . - Examens complémentaires non biologiques
Les examens non biologiques se résument à l'imagerie et l'anatomie pathologique.En matière d'imagerie, les indications sont limitées à la toxoplasmose congénitale et à celle des immunodéprimés. En cas de séroconversion en cours de grossesse, le suivi échographique doit être mensuel, à la recherche de signes d'atteinte fœtale : dilatation ventriculaire, calcifications cérébrales, épaississement du placenta, hépatomégalie, ascite ou péricardite. Chez le nouveau-né, l'échographie transfontanellaire (figure 6.9) peut détecter des calcifications intracérébrales ou une dilatation ventriculaire. Chez l'immunodéprimé, l'imagerie est fonction de la localisation clinique : tomodensitométrie ou résonance magnétique nucléaire, en particulier pour les atteintes cérébrales, avec la traditionnelle image en « cocarde » prenant le contraste après injection (figure 6.5). Les lésions sont le plus souvent multiples.
L'étude anatomopathologique peut être faite sur les biopsies de divers organes, essentiellement chez les immunodéprimés. En cas d'abcès cérébral, la biopsie stéréotaxique n'est souvent pratiquée qu'en cas d'échec du traitement d'épreuve. Quelle que soit la nature des biopsies, un fragment doit toujours être adressé au laboratoire de parasitologie.