5 . 3 - Solutions solides de substitution
Dans ce deuxième type de solution solide, les atomes du soluté B occupent des sites normalement occupés par des atomes de A dans le métal pur.
Si même taille (taille peu différente) et même système.
Ex : Ag (diamètre 288.3 pm) et Au (diamètre 287.8 pm) ont le même système CFC et ont des diamètres voisins.
1- Règles de Hume-Rothery
La solubilité des atomes en substitution peut être plus ou moins prévue par des lois empiriques, connues sous le nom de règles de Hume-Rothery (= règles qui régissent la formation des solutions) :
1. Règle du rayon atomique : (ou règle des diamètres atomiques ou « règle des 15% »).La différence entre les rayons atomiques ne doit pas être supérieure à 15% et la solubilité est inversement proportionnelle à la différence de taille des atomes.
2. Règle des structures électroniques (ou effet de valenceDéfinitionhttp://fr.wikipedia.org/wiki/Valence_%28chimie%29.La valence en chimie correspond au nombre de liaisons qu'un atome peut former afin de satisfaire à la règle de l'octet. Une valence de 1 indique qu'un atome peut se lier 1 fois, de 2 qu'il peut se lier 2 fois, etc. La valence maximale d'un élément chimique des deux premières périodes du tableau périodique est de 4.Les éléments plus lourds, en particulier les métaux de transition (qui par ailleurs ne respectent pas la règle de l'octet) peuvent avoir des valences supérieures à 4.Suivant sa valence, on dit d'un atome qu'il est monovalent, divalent, trivalent, tétravalent, pentavalent, hexavalent…La valence d'un ion en solution est sa charge, on parle alors d'électrovalence. ou effet d’affinité chimique) : les métaux électroniquement semblables peuvent former des solutions étendues en raison de la similitude de leur liaison.
3. Règle des valences : s’ils ont la même valence, ils vont se dissoudre facilement mais les métaux de faible valence dissolvent davantage un métal de valence semblable que ceux de valence élevée.
4. Règle des structures : la structure est déterminée en grande partie par les forces de liaison, il en résulte que des structures semblables présentent une grande intersolubilité plutôt que celles de structure différente.
Si tous les facteurs sont favorables, on observe le plus souvent une intersolubilité complète, c’est-à-dire une solution solide quelle que soit la concentration (solution solide illimitée). C’est le cas de l’or et du cuivre.
Dans le cas contraire, on a une solubilité restreinte (solution solide limitée). On aura des domaines de concentration très étroits. (ex : on aura des solutés ne dépassera pas 3 à 7%. Dès qu’on en mettra plus, le 2ème cristal apparaîtra).
2- Solutions solides ordonnées et désordonnées
Deux types de solutions solides de substitution peuvent être distinguées :
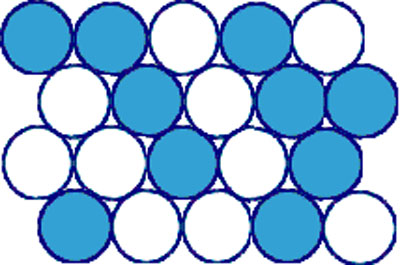
- Dans les solutions désordonnées (Figure 30), les sites de A occupés par des atomes de B sont répartis au hasard.
- A l’opposé, dans les solutions ordonnées (Figure 31), les atomes de soluté B sont répartis de façon régulière.
On a un cristal, donc les atomes sont placés régulièrement dans les sites, c’est la répartition des atomes qui est irrégulière.
Ex : Alliage Au-Cu à 50% (concentration atomique).
⇒ ce ne sont pas des formules chimiques. C’est une proportion mais qui ressemble à une formule chimique. AuCu signifie qu’il y a 45% d’or et 55% de cuivre, les 10% restant se place ailleurs dans le cristal. Les 2 métaux cristallisent dans le système CFC. Le diamètre du Cu est de 255.1pm. Au-dessus de 450°C, les atomes d’Au et de Cu sont répartis au hasard aux sommets et au centre du cube.
Solution solide ordonnée = superstructure.
Le passage de l’état ordonné à l’état désordonné se fait par changement de température, suffisamment longtemps.
3- Les phases intermédiaires (composés intermétalliques)
Lorsque l’alliage existe en une proportion très simple qui ressemble à une formule chimique, on observe également une solubilité limitée. Ces solutions solides forment des composés intermédiaires avec une stoechiométrie (composition atomique) définie. On parle dans ce cas de phases ou composés intermédiaires (ou composés intermétalliques dans le cas des métaux).
Il existe :
- Ceux qui ont le caractère de l’état métallique (conducteurs de la chaleur, de l’électricité et qui sont malléables).
Un corps est dit malléable lorsqu’il peut subir une importante déformation plastique à la compression (ex : le fer à cheval, le fer forgé).
Ex : Cu-Zn et certaines phases de l’alliage utilisé dans l’amalgame dentaire : Ag3Sn ou Cu6Sn5.
- Ceux qui ont un caractère métallique peu marqué : Ils ont un domaine d’existence moins étendu, une structure cristalline complexe. Ce sont des liaisons hétéropolaires (et non plus métalliques).
Ex : ZnS, Mg2Si qui sont des composés intermétalliques mais qui ont très peu le caractère métallique.