2 - Les liaisons atomiques
Lorsque deux atomes se lient, ils peuvent former une molécule. Cette liaison est appelée liaison primaire.
En fonction du degré d’interaction entre les atomes, un des trois états peut se former : gaz, liquide ou solide. Dans l’état gazeux, il y a peu ou pas de résistance au mouvement des atomes ou molécules, dans l’état liquide, la résistance est beaucoup plus importante mais les molécules peuvent se déplacer avec aisance. Par contre, dans l’état solide, le mouvement des atomes et des molécules est restreint à des vibrations localisées, bien que certains mouvements soient possibles par diffusion.
2 . 1 - La molécule
Les entités chimiques dont nous sommes entourés sont des molécules, soit des combinaisons d’éléments (atomes) de nature et de nombre divers. Les éléments se combinent entre eux pour former des molécules ; il se crée entre les éléments des liaisons de différentes forces.
L’évolution d’un système est une évolution tendant non seulement vers un état de moindre énergie (facteur enthalpiqueDéfinitionhttp://fr.wikipedia.org/wiki/Enthalpie.L'enthalpie (du préfixe en- et du grec thalpein: chauffer) est une fonction d'état de la thermodynamique, dont la variation permet d'exprimer la quantité de chaleur mise en jeu pendant la transformation isobare d'un système thermodynamique au cours de laquelle celui-ci reçoit ou fournit un travail mécanique.L'enthalpie a la dimension d'une énergie, et s'exprime en joules. : ΔH°) mais aussi vers un état plus probable ou état de plus grand désordre (facteur entropiqueDéfinitionhttp://fr.wikipedia.org/wiki/Entropie.En thermodynamique, l'entropie est une fonction d'état introduite au milieu du XIXe siècle par Clausius dans le cadre du second principe, d'après les travaux de Carnot. Clausius a montré que le rapport Q/T (où Q est la quantité de chaleur échangée par un système à la température T) correspond, en thermodynamique classique, à la variation d'une fonction d’état qu'il a appelée entropie, S et dont l'unité est le joule par kelvin (J/K).La thermodynamique statistique a ensuite fourni un nouvel éclairage à cette grandeur physique abstraite : elle mesure le degré de désordre d'un système au niveau microscopique. Plus l'entropie du système est élevée, moins ses éléments sont ordonnés, liés entre eux, capables de produire des effets mécaniques, et plus grande est la part de l'énergie inutilisée ou utilisée de façon incohérente. Boltzmann a formulé une expression mathématique de l'entropie statistique en fonction du nombre d’états microscopiques ? définissant l’état d'équilibre d'un système donné au niveau macroscopique : formule de Boltzmann S = k Ln ?.Cette nouvelle définition de l'entropie n'est pas contradictoire avec celle de Clausius. Les deux expressions de l'entropie résultent simplement de deux points de vue différents, selon que l'on considère le système thermodynamique au niveau macroscopique ou au niveau microscopique.Dans une période récente le concept entropie a été généralisé et a pénétré dans de nombreux domaines, tels que par exemple :• l'entropie de Shannon dans le cadre de la théorie de l'information en informatique;• l' entropie topologique, ainsi que l'entropie métrique de Kolmogorov-Sinaï, dans le cadre de la théorie des système dynamiques en mathématiques. : ΔS°). Dans la plupart des réactions chimiques existe un compromis entre facteur enthalpique et facteur entropique. ΔG° (variation d’énergie libre standard) = ΔH° - TΔS°
Tout système mécanique tend vers un état d’énergie inférieur. Deux à plusieurs éléments s’associeront entre eux pour former une MOLECULE à condition que cette dernière réalise une entité chimique plus stable que les éléments de départ. La spontanéité thermodynamiqueDéfinitionhttp://fr.wikipedia.org/wiki/Thermodynamique.On peut définir la thermodynamique de deux façons simples : la science de la chaleur et des machines thermiques ou la science des grands systèmes en équilibre. La première définition est aussi la première dans l'histoire. La seconde est venue ensuite, grâce aux travaux pionniers de Ludwig Boltzmann.Avec la physique statistique dont elle est désormais une partie, la thermodynamique est l'une des grandes théories sur lesquelles se fonde la compréhension actuelle de la matière.Les notions de chaleur et de température sont les plus fondamentales de la thermodynamique. On peut définir la thermodynamique comme la science de tous les phénomènes qui dépendent de la température et de ses changements. n’est toutefois pas le seul facteur à envisager pour expliquer le devenir d’une réaction chimique ; encore faut-il notamment que la réaction puisse se faire à une VITESSE (cinétique) appréciable.
La MOLECULE représente, à l’échelle microscopique, la plus petite partie d’un corps susceptible d’exister à l’état libre dans la nature tout en détenant l’ensemble des propriétés caractéristiques de la substanceDéfinitionhttp://fr.wikipedia.org/wiki/Substance.Communément, la substance est :• ce qui est produit par un organisme ;• l'essentiel du contenu de quelque chose (la substantifique moëlle (F. Rabelais) ;• ce que l'on consomme.D'un point de vue philosophique ou métaphysique, la substance est la réalité permanente qui sert de substrat aux attributs changeants. La substance est ce qui existe en soi, en dessous des accidents, sans changements. Elle s'oppose aux accidents variables, qui n'existent pas en eux-mêmes, mais seulement dans la substance et par la substance. Le terme vient du latin substare, se tenir debout ; de substantia, ce qui est dessous, le support.Gaston Bachelard a placé ce concept parmi les notions élémentaires dont il faut dépasser les attraits pour le rendre conforme à l'esprit scientifique : En réalité, il n'y a pas de phénomènes simples ; le phénomène est un tissu de relations. Il n'y a pas de nature simple, de substance simple : la substance est une contexture d'attributs.La substance est une notion employée dans le christianisme au sujet de l'Eucharistie. On note une différence entre l'Église catholique, qui parle de transsubstantiation, et d'autres Églises, qui parlent plutôt de consubstantiation.Dans le cadre du christianisme, Dans le cadre traditionnel des Veda, la substance a été retenue comme la première des sept catégories dans la théorie des catégories élaborée par les systèmes Nyâya et Vaiseshika ; cette dernière étant une philosophie atomique de la nature. De son côté, le bouddhisme substituant l'idée d'une évolution à celle d'un être stable rejette le concept de substance. Pour lui, le monde repose sur des dharmas, des facteurs rendant les existences transitoires possibles sous forme de phénomènes. originelle.Sauf rares exceptions, la molécule est un assemblage d’au moins deux éléments identiques ou non.
Il y a des corps simples = molécules constituées d’éléments identiques (ex. H2, N2, O2, F2, Cl2,…)
Et des corps composés = molécules formées d’éléments de nature différentes (H2S, H2O,CH3COOH, …).
2 . 2 - Origine des liaisons interatomiques
Toutes les LIAISONS ont une origine commune : l’attraction électrostatique entre les charges positives du noyau atomique et les charges négatives des électrons.
Il y a des attractions et des répulsions entre les charges électriques des électrons et des noyaux. L’équilibre entre cette force de répulsion et la force d’attraction électrostatique conduit à l’existence d’une distance d’équilibre entre deux atomes, caractéristique de la liaison considérée.
Des charges électriques de même signe se repoussent et des charges électriques de signe différent s’attirent.
Ex : Na+ et Cl- forme un cristal de chlorure de sodium.
S’il n’y avait pas de force (ou des forces extrêmement faibles) entre les atomes, il n’y aurait pas de molécule. C’est ce qui se passe avec les gaz rares (Ar, Kr, Xe, Ne), ils ne se combinent à rien. Et des forces qui se développent entre molécules donnent naissance à un solide ou un liquide.
L’énergie de liaison interatomique est l’énergie qu’il faut fournir pour briser la liaison. Elle s’exprime généralement en électrons-Volts (eV) par atome.
2 . 3 - Type de liaisons
On distingue deux types de liaisons :
- Les LIAISONS CHIMIQUES : elles donnent naissance à une nouvelle entité chimique. Cette liaison est très forte (énergie de liaison), de plusieurs électrons Volt.
Ex : H (gaz) et O (gaz) donnent de l’eau H2O (liquide).
- Les LIAISONS PHYSIQUES : ce sont des forces mais qui se développent entre molécules. Le résultat est un « état physique » (et non une nouvelle entité chimique), conduisant à une variation des propriétés physiques. Ces forces sont faibles, quelques dixièmes d’eV.
Ex : (1) M molécules d’eau à -10°C se rassemblent pour former de la glace.(2) L’eau (H2O) devrait être un gaz à la t° ambiante (comme H2S, H2Se) or ce n’est pas le cas. Pourquoi ? parce qu’il se développent des forces entre les molécules d’eau qui n’existent pas entre les molécules H2S et H2Se (cf Lliaison hydrogène).
2 . 4 - Les liaisons chimiques
1- Principe : Règle de l’octet
Il existe des théories plus élaborées actuellement mais plus abstraites. On prendra donc l’ancien modèle.
On a remarqué que certains gaz (Ne, Ar, Kr, Xe) ont tous, sur leur couche périphérique, 8 électrons et sont chimiquement inertes. Et, dans leurs diverses combinaisons, les atomes ont tendance à acquérir la configuration électronique du gaz rare le plus voisin c’est-à-dire à avoir 8 électrons sur leur couche périphérique.
8 e- : inertie ; < 8 e- : la molécule réagit. Les atomes réagissent pour obtenir ces 8 électrons soit par : perte ou gain d’électrons : liaison ionique, mise en commun d’électrons : liaison covalente, cas intermédiaires (covalent + ionique), liaison métallique.
2- La liaison ionique
La liaison ionique = métal fort + non-métal fort
Le métal fort, le plus fort de tous, se trouve à gauche et tout à fait en bas du tableau de Mendeléev : le césium. Le non-métal fort, le plus fort de tous, est à trouver à droite et tout à fait en haut : le fluor.
La liaison ionique est basée sur le transfert effectif d’un à plus d’un électron de la couche périphérique du métal fort sur la couche périphérique du non-métal fort ; le métal est donneur potentiel d’électron(s), le non-métal, accepteur.
Une combinaison ionique est une combinaison constituée d’un cationDéfinitionhttp://fr.wikipedia.org/wiki/Cation.Un cation (du grec cata- : en bas et iôn : qui va) est un ion qui, ayant cédé un ou plusieurs électron(s), porte une ou plusieurs charge(s) électrique(s) positive(s). On l'appelle ainsi car il est attiré, lors d'une électrolyse, par l'électrode négative, nommée cathode, de la même façon que les pôles de charges opposées des aimants s'attirent.En raison de la forte polarité de sa molécule, l'eau est un excellent solvant des ions. Le seul cation présent dans l'eau pure est l'ion oxonium (H3O+), usuellement et improprement nommé hydronium, formé par la solvatation du proton (H+) généré au cours de l'autoprotolyse. Les principaux cations inorganiques sont le calcium (Ca2+), le magnésium (Mg2+), le sodium (Na+), le potassium (K+) et l'ammonium (NH4+).En fonction du nombre de charges électriques, on distingue les cations monovalents, divalents, trivalents, etc. Les cations monovalents sont ceux des métaux alcalins (lithium, sodium, potassium, rubidium...) ; les métaux alcalino-terreux (béryllium, magnésium, calcium, strontium...) donnent des cations divalents ; les métaux de transition peuvent donner des cations mono-, di-, tri-, tétra-, pentavalents. Par exemple, le fer peut perdre deux ou trois électrons (Fe2+ et Fe3+).L'ion peut-être monoatomique, tel l'ion cuivreux (Cu+), ou polyatomique, tel l'ion ammonium. Il peut être inorganique, comme les ions cités précédemment, ou organique, comme l'ion benzalkonium. et d’un anionDéfinitionhttp://fr.wikipedia.org/wiki/Anion.Un anion (du grec ana- : en haut et iôn : qui va) est un ion qui, ayant capté un ou plusieurs électron(s), porte une ou plusieurs charge(s) électrique(s) négative(s). On l'appelle ainsi car il est attiré, lors d'une électrolyse, par l'électrode positive nommée anode, de la même façon que les pôles de charges opposées des aimants s'attirent.En raison de la forte polarité de sa molécule, l'eau est un excellent solvant des ions. Le seul anion présent dans l'eau pure est l'ion hydroxyde (OH–), issu de l'autoprotolyse. Les principaux anions inorganiques sont le carbonate (CO32–), l'hydrogénocarbonate ou bicarbonate (HCO3–), le sulfate (SO42–), le nitrate (NO3–), le dihydrogénophosphate (H2PO4–), l'hydrogénophosphate (HPO42–) et le phosphate (PO43–).L'anion peut-être monoatomique, tel l'ion chlorure (Cl–), ou polyatomique, tel l'ion nitrite (NO2–). Il peut être inorganique, comme les ions cités précédemment, ou organique, comme l'ion acétate (CH3COO–). , ions qui se maintiennent au voisinage l’un de l’autre, quasi au contact, par attraction coulombienneDéfinitionhttp://fr.wikipedia.org/wiki/Liaison_ionique.On appelle liaison ionique le lien causé par le transfert d'un ou de plusieurs électrons de valence (de la couche électronique externe) entre un atome (donneur) et un autre atome (receveur).La liaison ionique peut se décrire simplement par l'interaction électrostatique (attraction coulombienne de charges électriques opposées) entre des ions. Les sels sont des cristaux dont les ions sont liés par une liaison ionique. Il faut remarquer que les liaisons ioniques s'appliquent dans toutes les directions de l'espace et ne sont pas dirigées comme les liaisons covalentes. .
→ Il existe 3 types de force dans le noyau. La première force est appelée interaction forte, c'est une force d'attraction qui agit à très petite distance (de l'ordre du fentomètre : 1.10-16 m). La seconde est une force de répulsion appelée interaction coulombienne, c'est à dire qu'elle caractérise la répulsion/attraction entre 2 charges électriques identiques/différentes. La troisième est la force d'interaction faible, qui si le bilan énergétique le permet, transforme un proton en neutron et un positron.
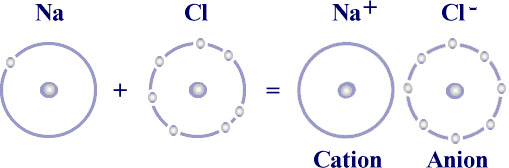
Ex : Na a 8e- au total et 1e- sur la couche périphérique, le Cl a 7 e- sur la couche périphérique. Ce qui donne le NaCl (chlorure de sodium, sel de cuisine). Il se constitue un édifice très stable, très compact (Figure 3).
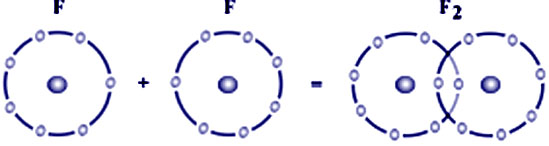
3- La liaison covalente
La liaison covalente = un non-métal + un non-métal
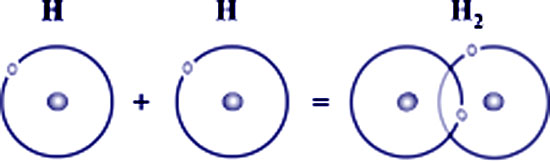
La liaison covalente est basée sur un échange bilatéral d’un à plus d’un électron célibataire entre les deux non-métaux concernés, ayant la même électronégativité, chacun d’eux étant à la fois donneur et à la fois accepteur d’électron(s) (Figure 4) (Figure 5).
La liaison covalente H-H réalise un judicieux compromis entre les forces d’attraction entre noyaux et électrons et les forces de répulsion entre noyaux (Figure 4).
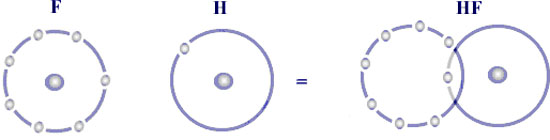
Une liaison covalente dative équivaut à une liaison covalente établie entre deux partenaires dont l’un apporte l’ensemble de la paire liante qu’il partage avec l’autre qui l’accepte pour moitié. Les deux atomes ont des électronégativités différentes, le plus électronégatif donne une paire d’électrons. Le non-métal le plus souvent impliqué dans ces liaisons est l’oxygène (porteur d’une lacune électronique, périphérie sextétiale) – Ex. HClO2.
4- La liaison intermédiaire
La liaison ionique et la liaison covalente constituent les deux types extrêmes de liaison. Le modèle de liaison le plus répandu - et notamment en chimie organique- est intermédiaire entre ces deux extrêmes : c’est la liaison covalente polaire ou polarisée ou hétéropolaire. Elle est partiellement covalente et partiellement ionique.
Une molécule covalente polaire résulte de la mise en commun d’électron(s) dans un échange bilatéral d’au moins un électron en provenance de chacun des 2 partenaires accusant une différence d’électronégativité comprise entre 0,5 et 1,7.
Exemples : HCl - L’hydrogène a 1 e- et le Chlore 7. L’H ne donne pas son e- sinon il n’en a plus. Il met a disposition son e- et il y a mise en commun d’un doublet entre l’hydrogène et le Chlore. Ce doublet statistiquement n’est pas au milieu, la probabilité est beaucoup plus grande de trouver le doublet près du chlore. L’hydrogène est fortement positif. Pour le NaCl (liaison ionique), la probabilité est de 100% autour du chlore.
Electronégativité
C’est la tendance plus ou moins grande d’un atome à attirer les électrons dans un édifice moléculaire. Ceci entraîne une polarisation de certaines molécules. La molécule se comporte alors comme un dipôle, c’est-à-dire comme deux charges opposées.
Lorsque l’un des deux atomes est beaucoup plus électronégatif que l’autre, la polarisation de la molécule est si importante que l’on est en présence de deux ions (ex : NaCl). Tout se passe comme si le sodium avait perdu son électron périphérique en devenant un ion positif Na+ et le chlore avait gagné cet électron, en devenant un ion négatif.
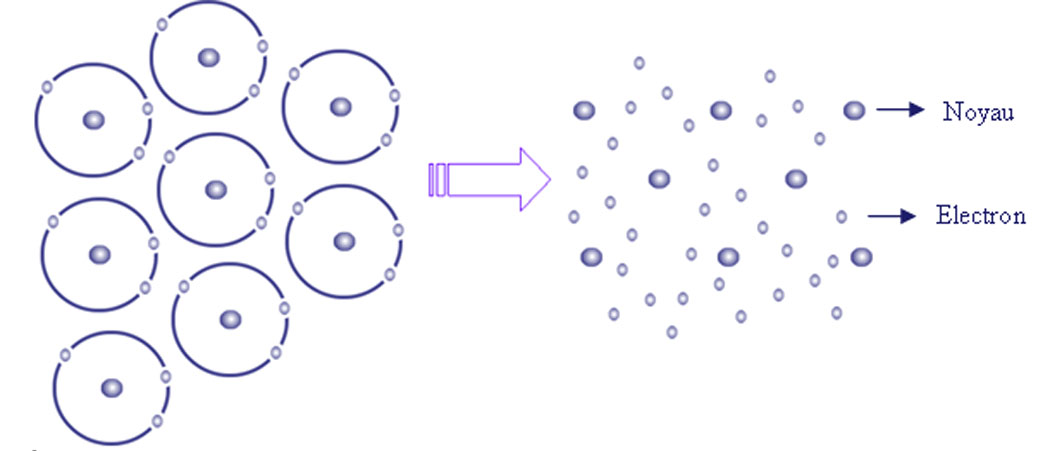
5- La liaison métallique
La liaison métallique concerne des atomes possédant un faible nombre d’électrons sur la couche externe, situation rencontrée dans le cas des métaux.
Ces électrons sont faiblement liés au noyau et ils peuvent facilement en être arrachés. Les atomes sont alors transformés en ions positifs. Les électrons arrachés aux atomes sont mis en commun entre tous ces atomes. Ils constituent un « nuage » ou « gaz » électronique qui assure la cohésion de l’ensemble (Figure 7).
Tous ces atomes ont perdu au moins un électron. Comme le cristal est neutre (ils restent dans le cristal, ils ne peuvent pas en sortir sinon le cristal devient positif et attire les e-).
La liaison métallique est donc un ensemble d’ions +. Chaque charge + est entourée par une charge -.
La liaison est très intense, plusieurs eV (environs 5 eV).