3 . 2 - Formation des solides
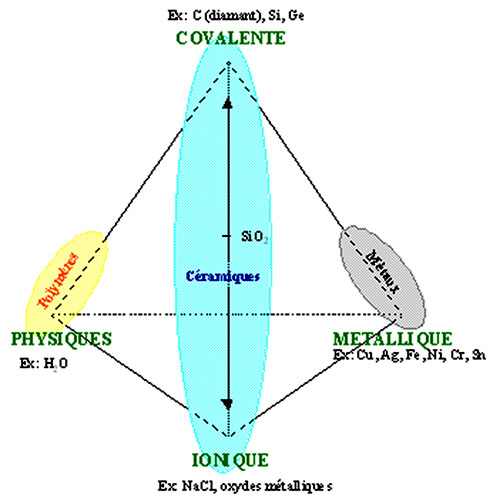
Les solides peuvent être classés en fonction des liaisons qui lient les atomes et les molécules entre eux. Cette classification permet de déterminer des solides ioniques, métalliques, covalents et moléculaires.
1- Solides ioniques
La structure cristalline des solides ioniques est régie par deux facteurs relativement simples - les ions sont entourés par des champs électrostatiques non directionnels : (1) Formation d’un réseau tridimensionnel régulier, énergétiquement bénéfique, entre les ions chargés positivement et négativement ; (2) puisque les charges opposées se repoussent, elles ne peuvent pas venir au contact l’une de l’autre.
Les ions chlorures, nitrures et oxydes des métaux sont les groupements de base des matériaux connus comme étant les céramiques, dans lesquels se trouvent les verres. Ces matériaux sont très stables grâce à leurs très fortes liaisons ioniques (Ex : Chlorure de sodium) (Figure 20).
2- Solides métalliques
Un arrangement similaire à celui des solides ioniques est possible avec la liaison métallique. Les atomes ont de faibles électronégativités et par conséquent, les électrons sont délocalisés entre tous les atomes. Le nuage électronique forme la base des métaux.
Les trois structures les plus fréquentes dans les métaux sont les structures cubiques centrées (CC) (Figure 12), cubiques à faces centrées (CFC) (Figure 13) et hexagonales compactes (HC) (Figure 14).
3- Solides covalents
A l’opposé des solides ioniques et métalliques, ici, la liaison est fortement directionnelle et cette directionnalité provoque de fortes contraintes sur les arrangements possibles entre les atomes.
Il n’y a que quelques cas dans lesquels les atomes d’un même élément se lient par liaison covalente pour former un solide ; Ceux-ci sont le carbone, le silicium et le germanium. Un exemple de solide à liaison covalente est le diamant, qui est formé de carbone (Figure 2). Le carbone présente un arrangement des électrons sur la couche externe tel qu’il nécessite quatre électrons supplémentaires pour obtenir une configuration similaire au néon. Dans le cas du diamant, c’est acquis par partage des électrons des atomes de carbone voisins. La direction de ces liaisons est telle qu’elles sont dirigées vers les quatre coins d’un tétraèdre ayant le noyau d’un atome de carbone en son centre.
Les solides covalents constitués d’un seul élément sont très rares. Les liaisons covalentes sont plus habituellement formées entre des éléments différents où chacun prend la configuration d’un gaz rare. Lorsque ces éléments ont réagi pour former ces liaisons, la molécule créée devient hautement non réactive envers les molécules du même type, et ceci ne produit pas la base pour la formation d’un réseau tridimensionnel.
De ce fait, les éléments liés par liaison covalente sont des molécules stables, et la plupart de ces éléments sont des gaz ou des liquides (ex. eau, oxygène, hydrogène). Pour que l’eau solidifie à 0°C, il faut qu’il y ait d’autres liaisons que cette liaison covalente primaire, ce sont des liaisons secondaires (liaisons hydrogènes).
4- Solides moléculaires
Une des conséquences du partage des électrons par deux ou plusieurs noyaux atomiques est la position préférentielles des électrons au voisinage d’une partie de la molécule. Par conséquent, la molécule acquière une charge positive à une de ses extrémités et une charge négative à l’autre extrémité, résultant en un dipôle électrique. Ces dipôles permettent des interactions entre les molécules et la formation de liaisons secondaires.
= Liaisons physiques (cf. Liaisons physiques).
Il est possible de créer une grande variété de molécules, certaines peuvent être solides à température ambiante.
Si les molécules sont suffisamment grandes, elles sont liées ensemble par de nombreuses interactions de dipôles.
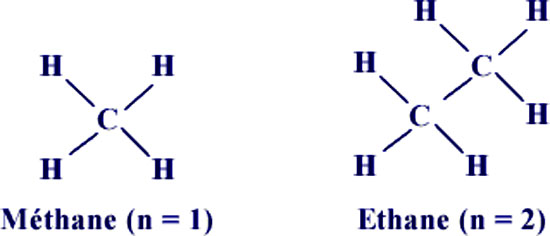
La faible force de liaison signifie que certains solides auront une température de fusion très basse, et la limite supérieure pour des molécules solides est d’approximativement 100°C.La meilleure façon pour apprécier la manière dont ces solides sont formés est à travers un groupe de molécules connu sous le nom d’alkanes linéaires. Ceux-ci sont basées sur une chaîne linéaire d’hydrates de carbone, avec comme formule générale CnH2n+2, où n est un nombre entier positif. La plus simple d’entre elles est le méthane (CH4), qui a n = 1 (Figure 21).
Si on enlève un hydrogène de chacune de 2 molécules de méthane et qu’on relie ces molécules par une liaison carbone-carbone, on obtient l’éthane (Figure 21). On peut continuer ce processus et obtenir de très larges molécules. Lorsque le nombre de groupements - CH2 - devient très important, il y a très peu de changement dans les propriétés de ces matériaux, qui sont connus sous le nom de polyméthylène. Ce nom est dérivé du mot poly- (signifiant beaucoup) et de l’unité structurale sur laquelle il est basé, le méthylène. Un matériau ayant ce type de structure est connu sous le nom de polymère, puisqu’il consiste en la répétition nombreuse d’unités appelées « mères » (cf. chapitre sur les polymères).
5- Solides et types de liaisons - Résumé
| Type de solide | Liaisons interatomiques | Réseaux cristallins | Propriétés | Exemples |
| Ionique | Ioniques | Toujours | Non directionnelle Forte énergie de liaison Dur, fragile | NaCI, MgO |
| Métallique | Métalliques | Toujours | Non directionnelle Energie de liaison variable Dureté variable, conducteur | Au, Cu, Fe, Mg |
| Covalent | Covalentes | Rarement | Directionnelle Très forte énergie de liaison Dur, isolant | Diamant (C), SiO2 (quartz) |
| Moléculaire | Liaisons secondaires dipôle-dipôle | Parfois | Non directionnelle Basse énergie de liaison Isolant | Cellulose microcristalline |