5 - Structure des alliages
5 . 1 - Généralités
Les métaux consistent en agrégats d’atomes régulièrement arrangés en structure cristalline. Les métaux ne se solidifient pas habituellement en un seul cristal, mais sont formés d’une multitude de petits cristaux. Les alliages des métaux utilisés sont obtenus par cristallisation de deux ou de plus de deux métaux, parfois avec des inclusions d’éléments non métalliques.
Un alliage est constitué d’un nombre de phases solides distinct – une phase est définie comme une part structurellement homogène du système qui est séparée des autres parties par une ligne de démarcation physique définie. Chaque phase a sa propre structure et ses propriétés associées.
⇒ Alliage ≠ mélange (ex. mélange de deux poudres d’or et de cuivre – on a toujours du cuivre et de l’or).
Alliage = solide obtenu par cristallisation d’un mélange de au moins 2 métaux liquides. Après solidification, on obtient un solide polycristallin et dans ce réseau, on va trouver des atomes des deux métaux (ex : AuCu).
Lorsque deux éléments sont « mélangés », le matériau résultant peut être un alliage à une phase ou un alliage à plusieurs phases. Celui qui est formé dépend de la solubilité d’un des éléments dans l’autre, et ceci est gouverné par la nature cristalline des éléments et par leur taille relatives.
Il y a essentiellement trois phases différentes qui peuvent former un alliage : un métal pur, une solution solide ou un composé intermétallique :
- Que ce soit en métallurgie, ou en dentisterie ou autre, on n’utilise jamais de métal pur (Exception en dentisterie : procéder d’aurification = dépose d’or pur dans des petites cavités – abandonné actuellement).
- Une solution solide est un mélange d’éléments à l’échelle atomique, et c’est analogue à un mélange de liquides qui sont solubles l’un dans l’autre. Il a deux types de solutions solides : solution solide de substitution et solution solide d’insertion.
La solidification d’un mélange liquide de deux métaux purs A et B (ou d’un métal et d’un élément non métallique) est un processus complexe, dont l’analyse peut se faire à l’aide des diagrammes de phases.
Un alliage binaire AB est généralement constitué à l’état solide d’un agrégat d’une ou plusieurs espèces de cristaux ; il est alors qualifié respectivement de monophasé ou de biphasé. Les cristaux sont eux mêmes formés de mélanges des deux espèces atomiques A et B, appelés solutions solides.
Les solutions solides d’insertion peuvent être formées d’atomes hétérointersticiels (impuretés) donc de défauts ponctuels ou d’éléments d’addition. Les solutions solides de substitution peuvent être formées d’atomes de remplacement non voulu (atome étranger de substitution) donc de défauts ponctuels ou d’atomes de remplacement voulu = alliage.
5 . 2 - Solutions solides d’insertion
Une solution solide est formée lorsque des atomes de soluté suffisamment petits arrivent à se placer entre les atomes de solvant. En pratique, le diamètre des atomes de soluté ne dépasse pas 60% du diamètre des atomes de solvant.
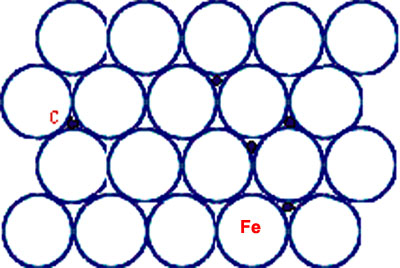
Si les atomes de l’élément d’alliage B ont un rayon atomique suffisamment faible, ils vont pouvoir s’introduire dans les interstices de la structure de A, donnant ainsi naissance à une solution solide d’insertion (ou solution solide interstitielle) (Figure 29).
Les atomes pouvant être placés en insertion sont : H, O, N, C, B.