9
-
Conclusions
Dans un article de décembre 2008 (The genetic architecture of metabolic traits: a data explosion, http://m.wired.com/wiredscience/2008/12/the-genetic-architecture-of-metabolic-traits-a-data-explosion/), Daniel Mc Arthur réagissait à propos d'articles publiés simultanément dans Nature Genetics concernant l'architecture génétique de traits phénotypiques et métaboliques. Deux papiers concernaient des GWAS sur le taux de glucose sanguin, un troisième rapportait des résultats de GWAS sur le diabète de type 2 et la sécrétion d'insuline; deux article exploraient la dyslipidémie par GWAS, et un article explorait par GWAS les déterminants génétiques d'une dizaine de traits phénotypiques (triglycéridémie, HDL cholestérol, LDL cholestérol, glycémie, insulinémie, taux plasmatique de CRP, IMC, pression artérielle systolique et pression diastolique).
 Prokopenko I et al. , Variants in MTNR1B influence fasting glucose levels Nature Genetics 41, 77 - 81 (2008) ;
Prokopenko I et al. , Variants in MTNR1B influence fasting glucose levels Nature Genetics 41, 77 - 81 (2008) ;  Lyssenko V et al. , Common variant in MTNR1B associated with increased risk of type 2 diabetes and impaired early insulin secretion Nature Genetics 41, 82 - 88 (2008) ;
Lyssenko V et al. , Common variant in MTNR1B associated with increased risk of type 2 diabetes and impaired early insulin secretion Nature Genetics 41, 82 - 88 (2008) ;  Kathiresan S et al. , Common variants at 30 loci contribute to polygenic dyslipidemia Nature Genetics 41, 56 - 65 (2008) ;
Kathiresan S et al. , Common variants at 30 loci contribute to polygenic dyslipidemia Nature Genetics 41, 56 - 65 (2008) ;  Aulchenko YS et al. , Loci influencing lipid levels and coronary heart disease risk in 16 European population cohorts Nature Genetics 41, 47 - 55 (2008)
Aulchenko YS et al. , Loci influencing lipid levels and coronary heart disease risk in 16 European population cohorts Nature Genetics 41, 47 - 55 (2008)  Sabatti C et al. , Genome-wide association analysis of metabolic traits in a birth cohort from a founder population Nature Genetics 41, 35 - 46 (2008)
Sabatti C et al. , Genome-wide association analysis of metabolic traits in a birth cohort from a founder population Nature Genetics 41, 35 - 46 (2008)
Daniel Mc Arthur mettait en relief le décalage entre la masse de variants génétiques révélés par ces études de grande ampleur et donc à priori impliqués dans l'héritabilité des traits, et la petite part de variance génétique expliquée par l'ensemble de ces variants génétiques. Par exemple l'une des études concernant 36610 sujets et la somme des variants détectés n'expliquait que 1.5% de la variance de la glycémie. Il remarquait aussi que deux études concernant la dyslipidémie et impliquant plus de 20000 sujets mettaient en relief un total de 18 loci dont un seul était commun aux deux études. La dernière étude (Sabatti C et al.), la plus petite en terme du nombre de sujets (n=4763), avait le grand avantage sur les autres de s'intéresser à une population homogène (toutes les personnes nées en 1966 dans deux des provinces du nord de la Finlande) et les auteurs, en plus de l'étude des déterminants génétiques par GWAS ont aussi évalué un certain nombre d'influences environnementales. Ce travail a l'avantage d'avoir permis de réaliser un état des lieux quant à ce que les données (de l'époque) permettaient de prédire tant du point de la part de variance génétique (héritabilité) que de la part de la variance environnementale.
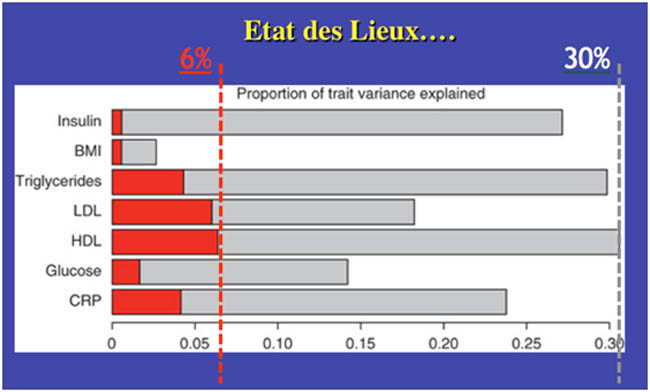
Les barres grises montrent la part de variance expliquée par les connaissances "actuelles" (variance génétique+variance environnementale), la part de variance génétique explicable par les variants génétiques connus est représentée par les barres rouges.
On voit que dans le meilleur des cas, nos connaissances (génétiques et environnementales) actuelles ne permettent d'expliquer que 30% de la variance du HDL cholestérol, dont seulement 6% par les variants génétiques déjà identifiés. Pour les autres traits métaboliques la situation est bien moins avancée surtout en ce qui concerne la variance que la génétique (part d'héritabilité) est capable d'expliquer.
Ces résultats montrent que l'approche des maladies multifactorielles ne peut se dispenser d'inclure les variables "environnementales" dans les modèles d'analyse. Cette nécessité soulève de gros problèmes car contrairement à un génotypage de variant génétique, il est très difficile de recueillir de manière objective les variables environnementales (passées et présentes) d'un sujet donné. Par ailleurs ce recueil risque d'être toujours entaché d'une part d'incertitude. On voit donc que les données récentes de la littérature pour stimulantes qu'elles soient invitent à une grande modestie quant à notre connaissance des déterminants d'une maladie multifactorielle et néanmoins ouvrent de vastes nouveaux champs d'investigation.
En savoir plus:  Tishkoff S et al. , Ten years of genetics and genomics: what have we achieved and where are we heading? Nat Rev Genet 2010 vol. 11 (10) pp. 723-33
Tishkoff S et al. , Ten years of genetics and genomics: what have we achieved and where are we heading? Nat Rev Genet 2010 vol. 11 (10) pp. 723-33  Cordell HJ , Detecting gene-gene interactions that underlie human diseases Nature Reviews Genetics 2009 vol. 10 (6) pp. 392-404
Cordell HJ , Detecting gene-gene interactions that underlie human diseases Nature Reviews Genetics 2009 vol. 10 (6) pp. 392-404  Sudmant PH , Diversity of human copy number variation and multicopy genes. Science 2010 vol. 330 (6004) pp. 641-6.
Sudmant PH , Diversity of human copy number variation and multicopy genes. Science 2010 vol. 330 (6004) pp. 641-6.  Mc Clellan J , Genetic heterogeneity in human disease. Cell 2010 vol. 141 (2) pp. 210-7.
Mc Clellan J , Genetic heterogeneity in human disease. Cell 2010 vol. 141 (2) pp. 210-7.  Williams A et al. , Interchromosomal association and gene regulation in trans. Trends Genet 2010 vol. 26 (4) pp. 188-97.
Williams A et al. , Interchromosomal association and gene regulation in trans. Trends Genet 2010 vol. 26 (4) pp. 188-97.  Bogardus C, Missing heritability and GWAS utility. Obesity 2009 vol. 17 (2) pp. 209-10.
Bogardus C, Missing heritability and GWAS utility. Obesity 2009 vol. 17 (2) pp. 209-10.

11/11






 Prokopenko I et al. , Variants in MTNR1B influence fasting glucose levels Nature Genetics 41, 77 - 81 (2008)
Prokopenko I et al. , Variants in MTNR1B influence fasting glucose levels Nature Genetics 41, 77 - 81 (2008)