- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Document 1 : Description de la réponse inflammatoire
- 2 - Document 2 : Mécanismes à l'origine des signes clinico-biologiques de la réaction inflammatoire
- 3 - Document 3 : Conduite à tenir devant un syndrome inflammatoire et/ou une vs élevée inexpliquée. Conduite à tenir devant un syndrome inflammatoire
- 4 - Document 4 : Points d'impacts sur les thérapeutiques anti-inflammatoires
- Version Enseignants
-
Version PDF

-
Contenu
- Evaluations
- Annexes
- Votre Avis
- Ressources Enseignants
1 . 2 - Phase d'amplification
1 . 2 . 1 - Afflux des cellules
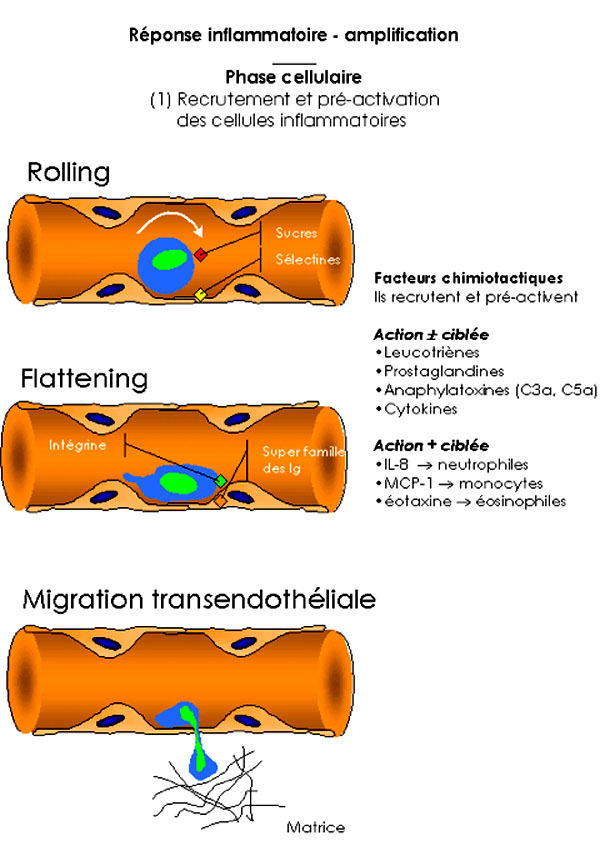
Après l'étape d'initiation, la réaction inflammatoire se développe avec la migration et la domiciliation (mobilisation, margination, diapédèse) de différents types de cellules (effecteurs secondaires) au sein du foyer inflammatoire. Ce phénomène est lié à l'action coordonnée, d'une part de facteurs chimiotactiques, d'autre part de molécules d'adhérence exprimées à la surface des cellules sanguines circulantes et sur les autres surfaces de contact (endothélium, matrice extracellulaire). La cellule endothéliale, à l'interface sang/tissu, joue un rôle essentiel. La nature des facteurs chimiotactiques et des molécules d'adhérence impliqués détermine la composition de l'infiltrat cellulaire avec un afflux préférentiel de polynucléaires (neutrophiles ou éosinophiles) ou de monocytes. Les facteurs chimiotactiques recrutent mais aussi activent les cellules pour les rendre plus sensibles à l'action d'autres médiateurs grâce à l'expression accrue de molécules de surface (molécules d'adhérence, récepteurs de cytokines, de chémokines ou autres récepteurs).
1.2.1. 1. Les molécules d'adhérence
Une grande variété de molécules d'adhérence a été identifiée (les sélectines, les intégrines, la superfamille des immunoglobulines). Elles interviennent dans chacune des séquences de migration des leucocytes. On note d'abord une phase de décélération des leucocytes à la surface de l'endothélium (phénomène de " rolling "). Cette phase est liée à une interaction réversible, de faible affinité, entre les polysaccharides (à la surface des leucocytes) et les sélectines (à la surface des cellules endothéliales). Les leucocytes sont activés par ce premier contact et par la présence de facteurs chimiotactiques dans l'environnement vasculaire inflammatoire. Ils adhérent alors plus fortement à l'endothélium (phénomène de " flattening ") par l'intermédiaire de contacts entre les intégrines des leucocytes et les molécules de la superfamille des immunoglobulines des cellules endothéliales (VCAM-1, ELAM-1, ICAM-1). La migration trans-endothéliale s'opère alors (étape de diapédèse) et le leucocyte entre en contact, de l'autre côté de la paroi vasculaire, avec les éléments de la matrice extracellulaire. Cette étape finale dépend aussi d'interactions entre les intégrines et les membres de la superfamille des immunoglobulines. Il existe par ailleurs des contacts entre la molécule CD44 des leucocytes et l'acide hyaluronique de la matrice extracellulaire.
1.2.1.2. Les facteurs chimiotactiques
Les leucocytes expriment, de manière constitutive ou induite, des récepteurs de surface sensibles à l'action de facteurs chimiotactiques très variés (médiateurs lipidiques, anaphylatoxines, cytokines et chémokines). L'aptitude des leucocytes à répondre aux signaux chimiotactiques dépend du nombre et du type de récepteur exprimé à la surface de la cellule. Certains facteurs exercent des effets sur une grande variété de cellules. D'autres ont des effets plus ciblés. Ainsi, de nombreuses cellules sont sensibles à l'action des médiateurs lipidiques tels que le PAF. acether, les leucotriènes (LTB4, LTD4…) ou les prostaglandines. Les anaphylatoxines C5a, C3a ; certaines cytokines et bien sûr les chémokines sont aussi chimiotactiques. En revanche, une action plus ciblée peut expliquer l'afflux préférentiel d'une population cellulaire au sein du foyer inflammatoire. L'IL8 exerce surtout ses effets sur la lignée neutrophile ; le MCP-1 agit sur la lignée monocytaire et sur les mastocytes ; l'IL5 et l'éotaxine sont très actifs sur la lignée éosinophile.
Figure 2 : Réponse inflammatoire - Amplification
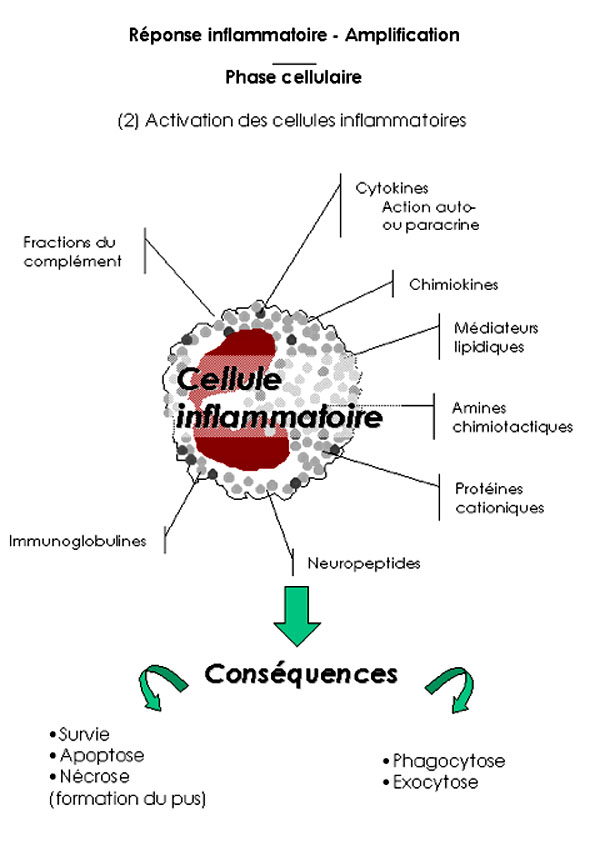
1 . 2 . 2 - Activation des cellules
Les cellules recrutées (neutrophiles, éosinophiles, monocytes, lymphocytes) ou résidentes (mastocytes) sont sensibles aux nombreux messages que leur adresse leur environnement grâce à l'expression constitutive et surtout induite d'une grande variété de molécules de surface. Les cellules recrutées dans les tissus-cibles interagissent localement avec différents médiateurs libérés dans le foyer de la réaction (cytokines, chémokines, immunoglobulines, fractions du complément, médiateurs lipidiques, protéines cationiques, neuropeptides…). Le décodage et l'intégration de l'ensemble de ces signaux membranaires aboutissent alors à l'induction d'un programme fonctionnel (survie ou apoptose ou nécrose cellulaire ; phagocytose de micro-organismes de débris cellulaires ou exocytose de produits préformés ou sécrétion sélective de produits néoformés…). L'activation des cellules recrutées entraîne la production de chémokines et de cytokines comme l'IL-1, l'IL-6, le TNFa. Celles-ci favorisent l'entretien et l'amplification de la réponse inflammatoire (action autocrine ou paracrine des cytokines).
1 . 2 . 3 - Les médiateurs préformés
Ces médiateurs, rapidement disponibles, peuvent être libérés en totalité après exocytose des granules des leucocytes (effet immédiat).
1.2.3.1. Les amines vasoactives
Elles sont surtout impliquées dans la phase d'initiation et exercent des effets vasomoteurs (histamine des mastocytes, sérotonine des plaquettes) mais aussi chimiotactiques (histamine des mastocytes).
1.2.3.2. Les protéases
Des protéases sont surtout impliqués dans la phase d'initiation de la réaction inflammatoire (phase vasculaire). Ils interagissent dans les systèmes de la coagulation, le système contact, la fibrinolyse, l'activation du complément (activateurs du plasminogène, kallicreine). Des sérine-protéases (plasmine, granzyme B) et surtout des metalloprotéases (MMPs stimulés par les cytokines pro-inflammatoires) agissent aux étapes ultérieures. En participant à la protéolyse matricielle, elles favorisent les migration des cellules au sein de la matrice extracellulaire. Elles peuvent aussi exercer des effets délétères sur les tissus-cibles. Ces protéases sont sous le contrôle d'antiprotéases (a1-antitrypsine, a2-antiplasmine…) et d'anti-métalloprotéases (tissular inhibitor molecular protein ou TIMPs). Toute altération des équilibres protéases/anti-protéases peuvent entraîner de graves processus lésionnels (cf chapître C. Réparation). Ainsi certains déficits en inhibiteurs de protéases comme les SERPINS (Serine-Protease-Inhibitors) tel que l'inhibiteur du C1 esterase est à l'origine de l'œdème angioneurotique. Le déficit en a-1 anti-trypsine s'observe dans l'emphysème pulmonaire. Cette activité protéolytique est accrue sous l'effet des cytokines comme le TGFb, l'IL1-b et le TNFa provenant des cellules inflammatoires.
1.2.3.3. Les protéines cationiques
Ces protéines cationiques sont particulièrement retrouvées dans les granules spécifiques des polynucléaires éosinophiles (major basic protein ou MBP, protéine cationique de l'éosinophile ou ECP, neurotoxine ou EDN, peroxydase spécifique de l'éosinophile ou EPO). Ces protéines sont cytotoxiques (caractère basique, activité perforine-like) et activatrices. Elles sont, en effet, capables de stimuler des cellules du voisinage et d'induire la libération d'autres médiateurs de la réponse inflammatoire tels que des médiateurs lipidiques, des cytokines, des chemokines (phénomène d'amplification de la réaction inflammatoire). Ces protéines basiques sont libérées après exocytose ou sécrétion. Leurs effets délétères ont surtout été décrits dans le cadre de la réaction inflammatoire dans l'asthme allergique (lésions de la muqueuse bronchique). Les polynucléaires neutrophiles exercent surtout des activités d'endocytose et de phagocytose. Il participent ainsi à la destruction locale des micro-organismes extracellulaires et principalement des bactéries. Certaines enzymes impliquées dans ces processus de bactéricidie, notamment la myéloperoxydase ou MPO et la proteinase 3 sont la cible d'auto-anticorps dans certaines maladies inflammatoires (cf. les vascularites).
1.2.3.4. Les chémokines et les cytokines
Ces médiateurs ne sont pas uniquement le produit d'une néo-synthèse. A titre d'exemple, certains chemokines (extaxine, RANTES) et cytokines (IL-4, IL-5, TNF alpha) sont stockées dans les granules spécifiques du polynucléaire éosinophile. Ainsi, elles sont immédiatement disponibles après activation cellulaire et dégranulation.
2/8