5
-
Le conseil génétique
Lorsqu’un diagnostic de mucoviscidose est posé, au delà de la prise en charge de l’enfant en milieu spécialisé, une prise en charge génétique s’impose pour le couple et ses apparentés (28). C’est en ayant en main l’ensemble des connaissances accumulées depuis 20 ans que l’on peut proposer un conseil génétique
(cf. note : 1)éclairé aux patients, à leurs familles et plus largement à leur apparentés. Nous allons détailler les différentes situations dans lesquelles un conseil génétique doit être proposé aux familles.
Il faut rappeler que pour cette maladie de transmission récessive dont l’incidence observée varie de 1/3000 à 1/7000 selon les régions, le taux de porteurs de l’allèle muté dans la population est de 1/30 à 1/35.
5
.
1
-
Prise en charge des couples à risque de 1/4
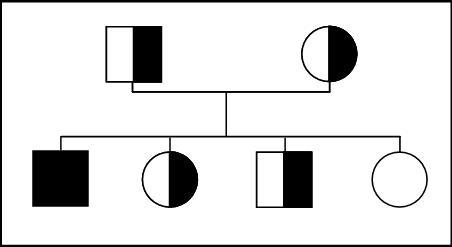
Dans cette situation, les deux parents sont hétérozygotes c’est-à-dire porteurs asymptomatiques d’une mutation dans le gène CFTR (Figure 1). Dans la très grande majorité des cas, il s’agit de couples qui ont donné naissance à un enfant atteint lors d’une précédente grossesse. Il peut également s’agir de couples qui ont été identifiés à la suite d’un dépistage en cascade réalisé dans les familles à risque (où la naissance d’un enfant atteint a déclenché une recherche des porteurs chez les apparentés) ou suite à la détection d’un intestin hyperéchogène lors du suivi échographique des grossesses.
Le risque de récurrence à chaque grossesse étant de 25 %, un conseil génétique sera proposé à ces couples. Une information complète leur sera donnée sur la maladie elle-même, sur le risque de récurrence à chaque grossesse et une possibilité de diagnostic prénatal, s’ils le souhaitent, leur sera proposée (29).
Ce diagnostic prénatal sera possible par choriocentèse dès 11 semaines d’aménorrhée voire un peu plus tard à partir de 16 semaines d’aménorrhée par amniocentèse. Dans tous les cas, le diagnostic sera réalisé par biologie moléculaire et l’on recherchera dans l’ADN fœtal la présence ou l’absence des mutations du gène CFTR identifiées chez les parents. Le statut du fœtus – non porteur, hétérozygote ou atteint – sera déterminé. On s’assurera, pour chaque diagnostic prénatal, de la présence de matériel paternel, ce test reposant sur l’étude des microsatellites situés à proximité du gène ou sur l’ensemble du génome. Le résultat du diagnostic prénatal est obtenu en 48 heures. Dans 98 % des cas, les mutations paternelles et maternelles sont connues et le diagnostic est direct par recherche de ces mutations au niveau de l’ADN fœtal. Si l’une des mutations n’est pas connue, on s’appuiera sur un diagnostic indirect en utilisant des marqueurs polymorphes intra ou extra géniques qui caractérisent le chromosome porteur de l’allèle délétère inconnu (30).
Nous avons récemment fait le bilan de notre activité de 15 années de diagnostic prénatal de mucoviscidose et nous avons pu montrer que la spécificité de l’analyse de biologie moléculaire était de 100 % (31). Il faut également noter à ce propos que la très grande majorité (96 %) des couples à risque de 1/4; pour lesquels le diagnostic de mucoviscidose fœtale est porté opte pour une demande d’Interruption pour motif Médical de la Grossesse (IMG).
Une seconde possibilité peut être proposée à ces couples à risque de 1/4;. Il s’agit du diagnostic préimplantatoire réalisé dans le cadre d’une procréation médicalement assistée, après une technique d’ICSI (Intra Cytoplasmic Sperm Injection) qui permet d’injecter l’ADN d’un spermatozoïde dans un ovocyte (32). Il s’agit ensuite d’analyser au stade 6/8 cellules le blastocyste en prélevant une cellule et en analysant le statut de ce futur embryon, et ensuite de ne réimplanter que les embryons non atteints. Ces techniques moléculaires très sophistiquées exigent un très haut niveau de technicité. Le diagnostic préimplantatoire est réservé à quelques laboratoires (il y a en trois en France : CHRU Montpellier – Mireille Claustres ; APHP, Paris – Arnold Munnich ; CHRU Strasbourg – Stéphane Viville). Le délai d’attente est long, ce qui en limite l’accès, et sont considérées comme prioritaires les femmes qui ont déjà dû subir plusieurs IMG à la suite de diagnostics prénatals malheureusement positifs.
5
.
2
-
Prise en charge des couples à risque de ½
Les progrès réalisés ces dernières décennies dans la prise en charge de la mucoviscidose font que les patients sont de plus en plus nombreux à avoir des projets de vie de couples et des désirs d’enfants, et à solliciter un conseil génétique dans ce cadre.
Les femmes atteintes de mucoviscidose ont une fertilité normale dans 80 % des cas, tandis que les hommes sont stériles dans plus de 98 % des cas par agénésie bilatérale des canaux déférents. Ces derniers doivent donc être adressés vers un spécialiste pour confirmer ou non l’azoospermie et proposer, le cas échéant, une assistance médicale à la procréation.
Les patients atteints de mucoviscidose transmettant obligatoirement une des deux mutations dont ils sont porteurs, le risque pour leur couple d’avoir un enfant atteint avant toute étude de biologie moléculaire est élevé (1/60 i.e. 1*1/30*1/2). Il est donc primordial de réaliser une étude exhaustive du gène CFTR chez le conjoint, afin d’écarter le maximum de mutations et de pouvoir réduire le risque résiduel de mucoviscidose. En écartant 98 % ou 99 % des mutations selon l’origine du conjoint, le risque résiduel de mucoviscidose pour ce couple rejoint le risque d’un couple pris au hasard dans la population générale. En revanche, si le conjoint se révèle être hétérozygote, le couple devient à risque de 1/2; (Figure 2), et un diagnostic prénatal leur sera proposé dans le cadre d’une consultation de génétique.
5
.
3
-
Couples à risque a priori de 1/120
Il s’agit de couples dans lesquels l’un des partenaires est porteur à l’état hétérozygote d’une mutation dans le gène CFTR. Le risque a priori pour ces couples avant toute analyse de génétique est de 1/120 (1/2*1/30*1/2).
Le but de l’étude moléculaire va être de modifier cette probabilité a priori de 1/120 en probabilité a posteriori après avoir analysé le gène CFTR chez le conjoint a priori non porteur. Une première étude simple recherchant la présence éventuelle de la mutation F508del et des 30 mutations les plus fréquentes du gène permet d’écarter environ 90 % des mutations du gène (ce taux de couverture peut varier légèrement selon les régions de France et l’origine ethnique des sujets). Si l’on s’arrête à ce niveau d’analyse du gène, le risque résiduel pour ce couple est de 1/1200. Ceci est satisfaisant mais nous avons pour habitude de proposer une étude plus complète du gène par criblage systématique des exons les plus fréquemment mutés, ce qui nous permet d’écarter au moins 95 % des mutations du gène et de proposer à ces couples un risque résiduel de mucoviscidose pour leurs enfants de 1/2500. Ce risque devient proche du risque encouru par un couple pris au hasard dans la population générale.
Lorsqu’une mutation est identifiée chez le conjoint du porteur, nous sommes alors en présence d’un couple à risque de 1/4; et la prise en charge correspond à celle décrits précédemment.
Notes
-
1 :
Les calculs de risque décrits dans ce chapitre sont réalisés en considérant un taux de porteurs de 1/30, qui correspond au risque moyen pour un individu d’être hétérozygote en Europe.
5/9