3
.
3
-
Calcifications
Causes
Les dépôts intratissulaires anormaux de calcium s’observent dans deux circonstances :
-
calcifications dystrophiques, dans les tissus lésés, nécrosés, alors que la calcémie est normale ;
-
calcifications dites métastatiques, dans les tissus sains à la faveur d’une élévation anormale de la calcémie.
Aspects macroscopiques
L’existence de calcifications se traduit macroscopiquement par une induration et une coloration blanc opaque, pierreuse (figure 2.18).
Divers aspects peuvent être réalisés, selon l’abondance et la distribution des précipités :
- « os de sèche » des pachypleurites ;
- « coque » des péricardites calcifiées ;
- « coquille d’œuf », dans l’athérosclérose calcifiée des gros vaisseaux ;
- « pierres », dans les fibromyomes utérins et les adénomes thyroïdiens involutifs calcifiés ;
- « craie » en cas de calcification partielle d’un tubercule caséeux ;
- « sable » dans le cas des sympexions prostatiques et des méningiomes psammomateux.
L’existence de ces calcifications est souvent bien mise en évidence par les radiographies.
Aspects histologiques
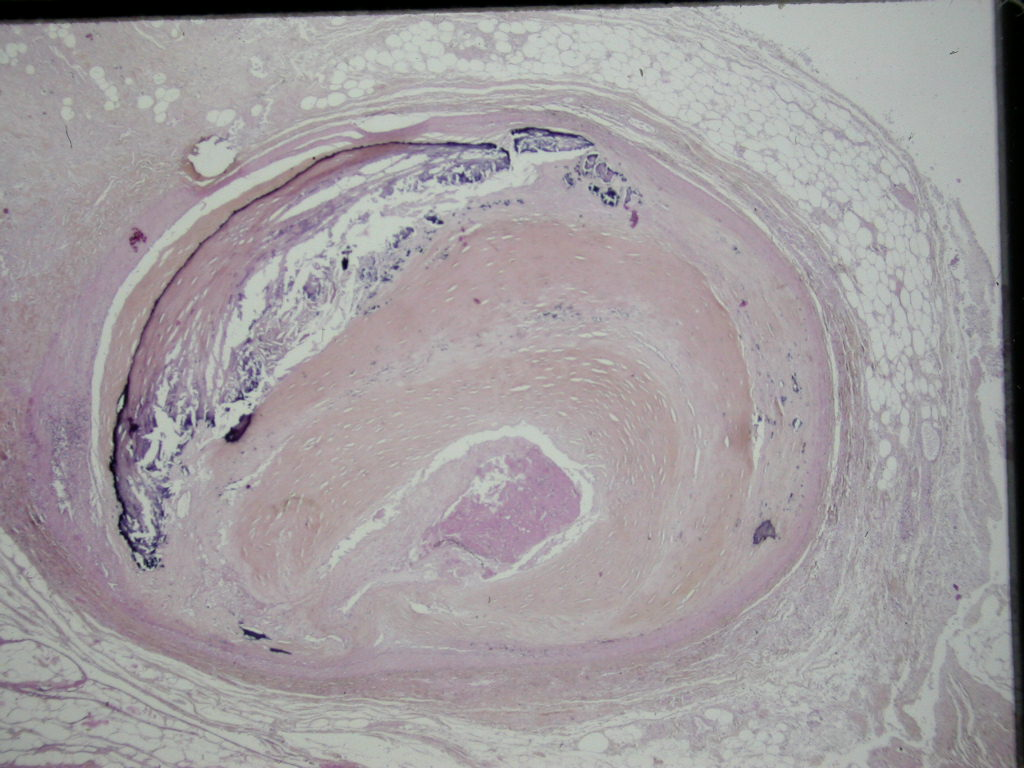
Sur une coloration par l’HES les dépôts calciques apparaissent denses, amorphes ou finement granulaires bleu-noir ou violacés (figures 2.19, 2.20). Ils sont le plus souvent extra-cellulaires, plus rarement intracellulaires, et alors débutants, surtout observés en microscopie électronique, en particulier dans les mitochondries.
Ils peuvent s’accompagner d’une réaction macrophagique, type réaction à corps étrangers, voire d’une véritable ostéogénèse métaplasique.
Ils peuvent être mis en évidence par des colorations électives, comme le rouge d’alizarine et la réaction de Von Kossa.
Leur présence en abondance peut nécessiter une décalcification préalable du tissu (chélateurs de calcium, acide) avant réalisation de techniques standards, ou bien l’utilisation de microtomes spéciaux pour objets durs.
Calcifications dystrophiques
Les calcifications peuvent survenir sur les tissus nécrosés, plus particulièrement dans la nécrose caséeuse de la tuberculose, la stéatonécrose, les infarctus anciens (myocarde), la « bouillie » athéromateuse (figure 2.19).
Elles peuvent aussi être favorisées par des altérations de la matrice conjonctive, comme dans la médiacalcose observée dans la média des artères au cours de la sénescence, les calcifications des tendons, de la dure-mère, des valves cardiaques (figure 2.18) ou du tissu sous-cutané.
Des calcosphérites, ou psammomes (calcification en strates concentriques) sont observées dans certaines tumeurs (méningiomes, carcinomes papillaires de la thyroïde ou de l’ovaire).
Des produits de sécrétion protéique accumulés dans des canaux peuvent servir de matrice aux dépôts de sels de calcium et donner naissance à des calculs (pancréas, voies biliaires).
La chondrocalcinose est à l’origine d’arthrites aiguës par précipitation de cristaux de pyrophosphate de calcium.
Calcifications métastatiques
Elles peuvent s’observer au cours d’hypervitaminose D, d’une ostéopathie destructrice (métastases osseuses, myélome), d’une hyperparathyroïdie primaire ou secondaire.
Elles siègent dans le rein, au niveau de l’interstitium et des cellules tubulaires, dans les poumons, dans les cloisons interalvéolaires et dans les vaisseaux, le foie et le myocarde.
3
.
4
-
Hémosidérose
L’hémosidérine est un pigment endogène brun jaunâtre qui dérive de l’hémoglobine. C’est une forme de stockage du fer dans les cellules. L’hémosidérine peut s’accumuler dans l’organisme, localement ou de façon diffuse. La surcharge peut être localisée (évolution d’une lésion hémorragique par exemple) ou diffuse (anomalie génétique du métabolisme du fer par exemple).
On peut aussi observer, rarement, des surcharges en fer d’origine exogène, divers tissus pouvant être infiltrés de particules de fer exogène, par exemple le poumon chez des soudeurs à l’arc et les ouvriers des mines de fer. La sidérose pulmonaire est sans conséquences physiopathologiques mais elle est fréquemment associée à une surcharge en silice (silicose), présente aussi dans l’air inhalé.
3
.
4
.
1
-
Caractéristiques histologiques
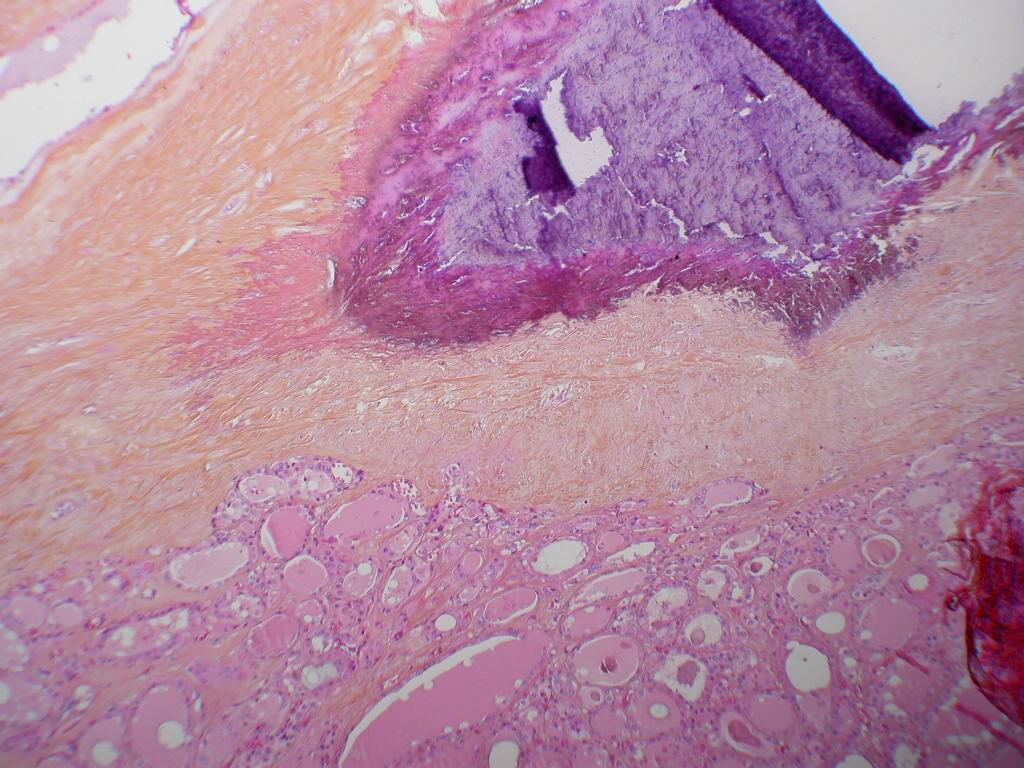
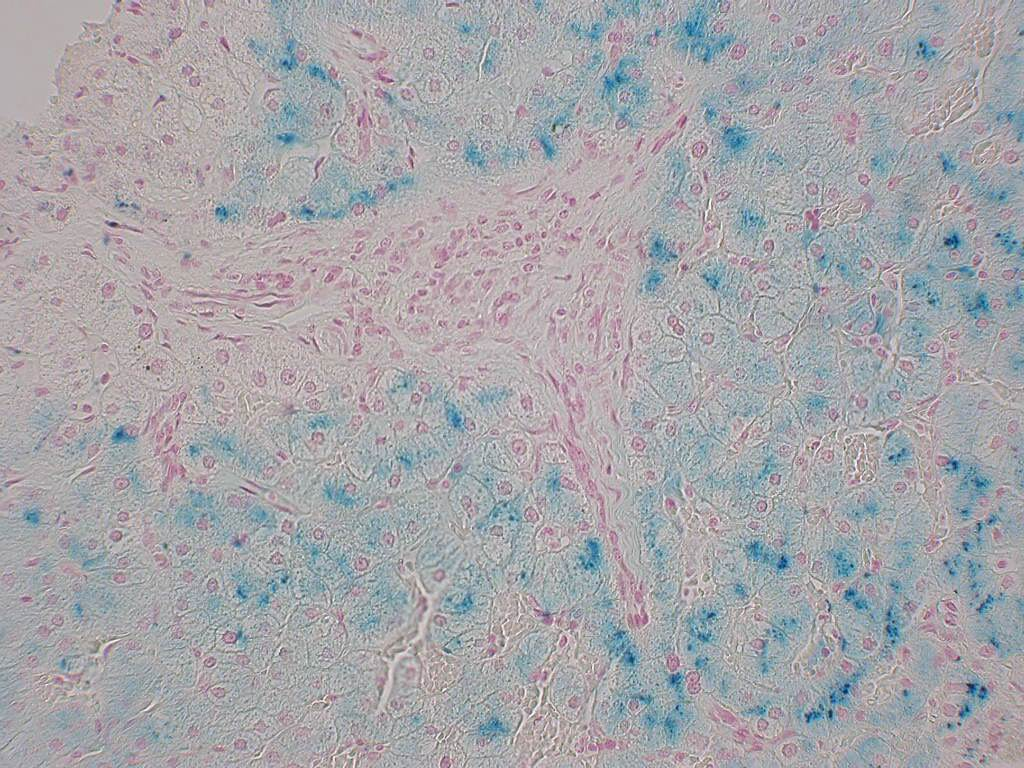
Sur une coloration par l’HES, les amas d’hémosidérine suffisamment volumineux sont visibles sous l’aspect de granulations brun ocre un peu brillantes (figure 2.21).
Des réactions sensibles et spécifiques permettent de caractériser le fer ionisé, la plus utilisée étant la réaction de Perls qui colore le fer ionisé en bleu (figure 2.22).
Hémosidérose localisée
L’accumulation locale de fer peut être liée à une hémorragie macroscopique ou de multiples hémorragies microscopiques.
Quand les hématies sont lysées, les lysosomes des macrophages transforment l’hémoglobine en hémosidérine, en passant par les diverses étapes de pigments intermédiaires (biliverdine, bilirubine), ce qui explique les variations de teinte de la zone traumatisée.
Exemples :
- sidérose du « poumon cardiaque » ;
- cicatrices « tatouées » des infarctus hémorragiques (poumon) ;
- évolution des thromboses.
3
.
4
.
2
-
Hémosidérose généralisée
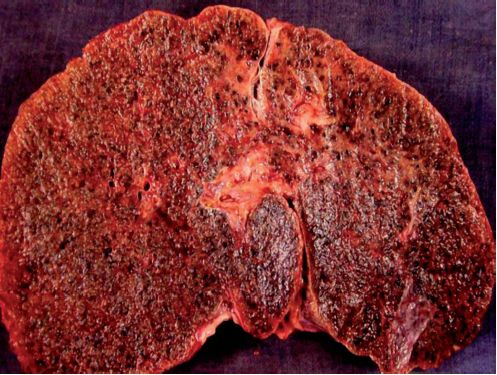
Elle correspond à une augmentation des réserves de fer de l’organisme, aboutissant à une surcharge polyviscérale. Le fer en excès s’accumule dans les macrophages et dans les cellules parenchymateuses. La surcharge peut être visible macroscopiquement si elle est importante, et se traduit alors par une coloration brune des viscères, voire une sensation de dureté et de crissement à la coupe (figure 2.23).
L’hémosidérose généralisée peut être primitive ou secondaire. Plusieurs mécanismes sont possibles :
- accroissement de l’absorption duodénale du fer alimentaire ;
- anomalie de l’utilisation du fer ;
- anémie réfractaire, hémolyses ;
- transfusions sanguines répétées.
3
.
4
.
3
-
Hémosidérose généralisées secondaires
Il s’agit habituellement d’une hémosidérose pure, sans sclérose. Le fer s’accumule dans les phagocytes mononucléés du foie (cellules de Küpffer), de la rate, de la moelle osseuse, des ganglions lymphatiques et dans les macrophages dispersés dans d’autres organes (peau, pancréas, rein). Lorsque la surcharge augmente, les cellules parenchymateuses peuvent être atteintes (foie, pancréas, cœur, glandes endocrines). La localisation des dépôts peut varier en fonction du mécanisme en cause.
Hémosidérose généralisée primitive ou hémochromatose
C’est une maladie héréditaire à transmission autosomique récessive. L’accumulation de fer dans les cellules parenchymateuses aboutit à leur destruction et à une fibrose, en particulier le foie, le pancréas, le cœur, et les glandes endocrines. Les manifestations cliniques résultent surtout de l’atteinte de ces organes. Elles apparaissent pour un stock de fer de 30 à 50 g (10 fois le stock normal).
Foie
Une surcharge ferrique est présente dans les hépatocytes, les cellules de Küpffer, les macrophages des espaces portes, et s’associe à une fibrose qui aboutit à une cirrhose micronodulaire souvent hypertrophique, de teinte rouille (figure 2.23). Le développement d’un carcinome hépatocellulaire est relativement fréquent.
Pancréas
La sidérose concerne les acini et les îlots de Langerhans et s’associe à une fibrose mutilante.
L’atteinte pancréatique explique en partie l’apparition d’un diabète insulinodépendant.
Myocarde
La sidérose concerne les cellules musculaires. Elle conduit à une fibrose à prédominance sous-endocardique pouvant être à l’origine d’une insuffisance cardiaque.
Glandes endocrines
Toutes peuvent être atteintes. En pratique, elles se manifestent surtout par une insuffisance hormonale :
- de la corticosurrénale, qui participe, en particulier, à la mélanodermie ;
- de l’antéhypophyse, spécialement par diminution de l’action gonadotrope. Ceci se traduit chez l’homme par une atteinte testiculaire. Chez la femme, une aménorrhée et une ménopause précoce résultent du même mécanisme.
Peau et muqueuses
Elles présentent une hyperpigmentation spéciale de teinte un peu ardoisée, diffuse ou localisée qui résulte de deux facteurs associés :
- la présence d’hémosidérine dans les histiocytes du derme et dans les cellules épithéliales des glandes sudoripares ;
- une mélanose épidermique, sans prolifération mélanocytaire en rapport avec la stimulation hypophysaire consécutive à l’insuffisance endocrinienne périphérique.
3
.
5
-
Maladies de surcharge lysosomiale
Les thésaurismoses lysosomiales sont induites par toute anomalie génétique mettant en jeu une protéine essentielle de la fonction lysosomiale normale (absence d’enzyme, d’activateur enzymatique, de protéine activatrice du substrat). Un métabolite s’accumule alors, et la localisation de l’activité enzymatique normale explique la localisation de la surcharge et donc les manifestations cliniques.
Ce trouble métabolique peut concerner le glycogène (glycogénose), les sphingolipides (gangliosidoses GM1 et GM2), les mucopolysaccharides (mucopolysaccharidoses I et II), et les mucolipides.
Le diagnostic repose sur la mise en évidence de la surcharge dans les tissus prélevés par biopsie (peau, muscle, rectum). Des colorations appropriées doivent être réalisées, complétées par une étude ultrastructurale, et la mise en évidence de l’anomalie enzymatique par les techniques d’histo-enzymologie. Le diagnostic nécessite une confirmation biochimique.
 Les maladies de surcharge
Les maladies de surcharge
6/8






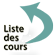
.jpg)
 Les maladies de surcharge
Les maladies de surcharge