2
.
2
.
2
-
Aspects de la nécrose
Les modifications observables en microscopie optique traduisent la dénaturation protéique et la digestion des organites par les enzymes protéolytiques des lysosomes.
La nécrose n’est manifeste que plusieurs heures après la mort cellulaire.
Nécrose cellulaire
Lésions élémentaires
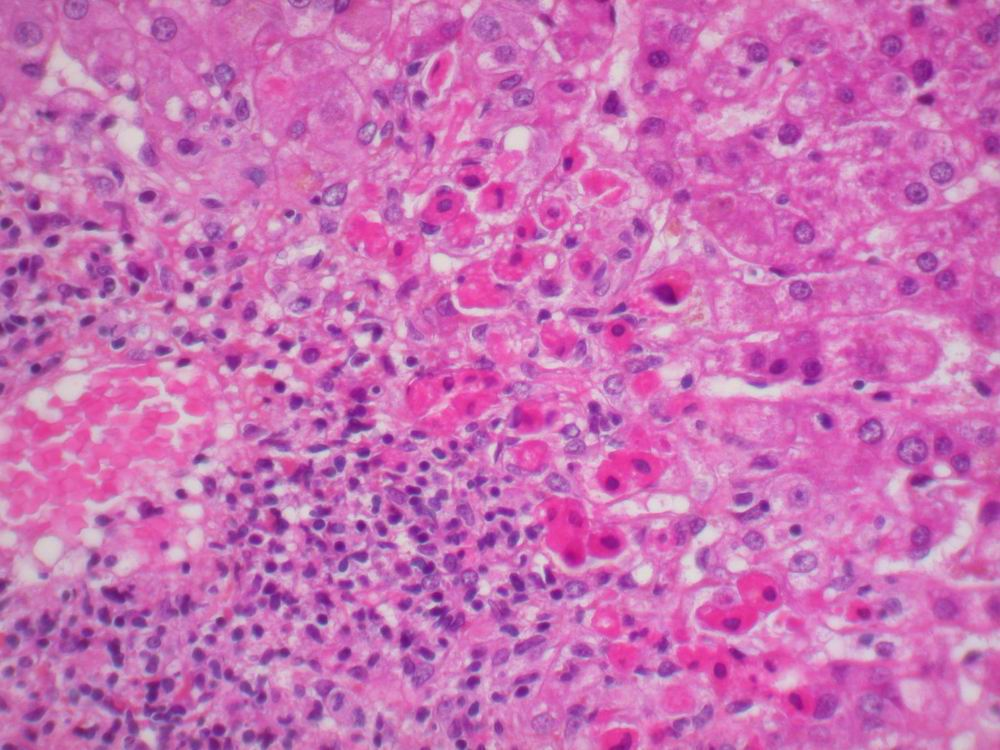
- Le cytoplasme de la cellule nécrosée est habituellement éosinophile, par diminution de l’ARN cytoplasmique (responsable de la basophilie cytoplasmique) et par augmentation de la liaison de l’éosine aux protéines cytoplasmiques dénaturées (figure 2.6). Il peut être homogène ou vacuolaire (par digestion enzymatique des organites).
- Les modifications nucléaires sont constantes et prennent plusieurs formes :
- pycnose : condensation avec rétraction du noyau et agglutination des amas chromatiniens contre la membrane nucléaire (figure 2.6) ;
- caryolyse : dissolution nucléaire avec perte des affinités tinctoriales ;
- caryorrhexis : fragmentation de la masse nucléaire.
Nécrose tissulaire
La nécrose cellulaire concerne habituellement des groupes de cellules dans un tissu, soumises aux mêmes agressions, par exemple lors d’un infarctus du myocarde après thrombose coronarienne, d’une nécrose œsophagienne après ingestion de caustiques etc., et non pas des cellules isolées, comme pour l’apoptose.
Les différentes formes de nécrose
-
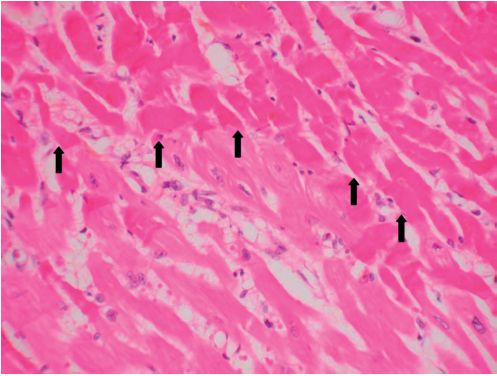
Nécrose de coagulation, fréquente, lorsque la dénaturation protéique est l’événement essentiel, comme au cours de l’ischémie (figures 2.7–2.8), des brûlures, de l’action de caustiques (figure 2.9). L’architecture tissulaire est préservée, fantomatique, les cytoplasmes sont éosinophiles et les noyaux pycnotiques ou en caryolyse.
-
Nécrose de liquéfaction, lorsque la digestion enzymatique domine, comme dans les infections à pyogènes. Elle comporte une perte totale de l’architecture tissulaire.
-
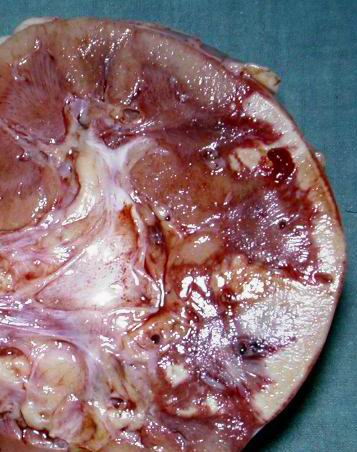
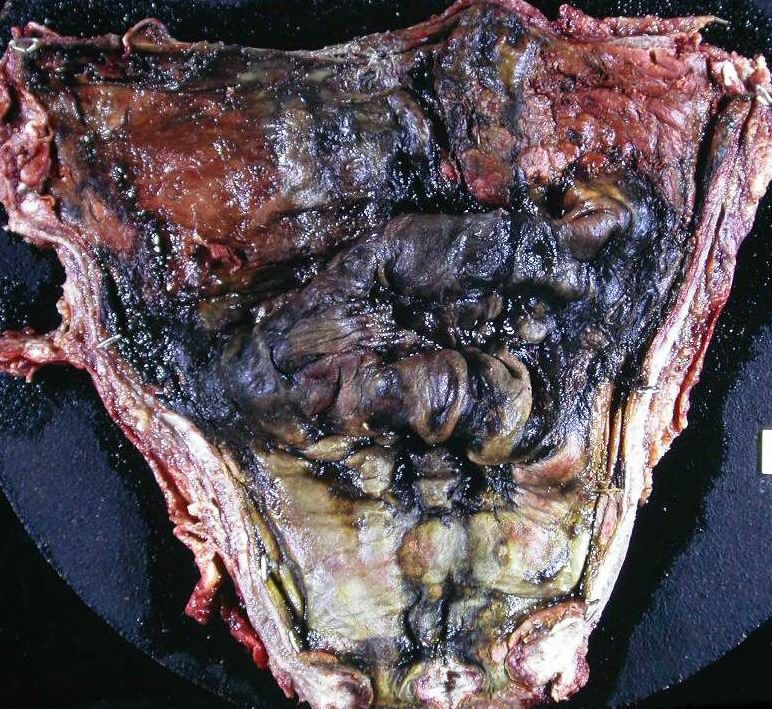
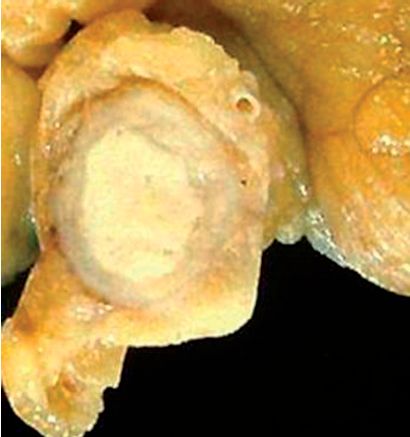
Nécrose caséeuse, caractéristique de la tuberculose. Macroscopiquement, elle rappelle le lait caillé, d’où son nom de caséum (figure 2.10). Histologiquement, on observe un matériel nécrotique grumeleux, éosinophile, sans architecture cellulaire ou tissulaire (figure 2.11).
-
Nécrose gangréneuse : elle est liée aux effets combinés de l’ischémie et de germes anaérobies.
-
Stéatonécrose : c’est la nécrose du tissu adipeux (figure 2.12) qui est habituellement observée au cours de la pancréatite aiguë, par libération des enzymes pancréatiques lors de la nécrose du tissu exocrine (lipase). Macroscopiquement, la stéatonécrose a un aspect caractéristique crayeux, blanchâtre.
2
.
2
.
3
-
Evolution de la nécrose
Habituellement la nécrose, quelle qu’elle soit, induit une réaction inflammatoire commune autour des cellules nécrosées, et selon la localisation, l’étendue, et la cause on aboutit soit à une restitution ad integrum soit à une cicatrice.
2
.
2
.
4
-
Physiopathologie, mécanismes biochimiques généraux
Quel que soit le facteur déclenchant, plusieurs mécanismes biochimiques sont possibles pour induire l’apparition d’une lésion cellulaire.
Ce n’est que dans certains cas que la cible est parfaitement connue : par exemple, certaines bactéries anaérobies, comme Clostridium perfringens, élaborent des phospholipases qui attaquent les phospholipides membranaires.
-
Déplétion en ATP : produit par phosphorylation oxydative ou glycolyse anaérobie, l’ATP intervient dans les transports membranaires, les synthèses protéiques, la lipogenèse, et les réactions de déacylation/réacylation. Ainsi les cellules à activité glycolytique élevées (hépatocytes) sont avantagées. Une déplétion en ATP et une diminution de sa synthèse sont induites par les agressions ischémiques et toxiques.
-
Oxygène et radicaux libres : la réduction de l’oxygène moléculaire en eau induit la formation de dérivés oxygénés réactifs, susceptibles de provoquer des lésions. Un déséquilibre entre leur production et leur élimination aboutit au « stress oxydatif ». Certaines agressions, comme les irradiations, participent à la création de radicaux oxygène actifs.
-
Perte de l’homéostasie du calcium : l’ischémie et certaines toxines provoquent une augmentation précoce de la concentration cytosolique du calcium, qui entraîne une augmentation non spécifique de la perméabilité membranaire et une activation de certaines enzymes qui ont une action délétère, comme les phospholipases, les ATPases, les endonucléases.
-
Anomalies de la perméabilité membranaire : une atteinte directe est possible par certaines toxines bactériennes, protéines virales, fractions lytiques du complément, produits des lymphocytes cytotoxiques, etc.
-
Lésions mitochondriales irréversibles : pouvant être induites par une augmentation du calcium, un stress oxydatif, par une destruction des phospholipides, elles sont une clé de la mort cellulaire.


3/8






.jpg)
.jpg)