2
.
3
-
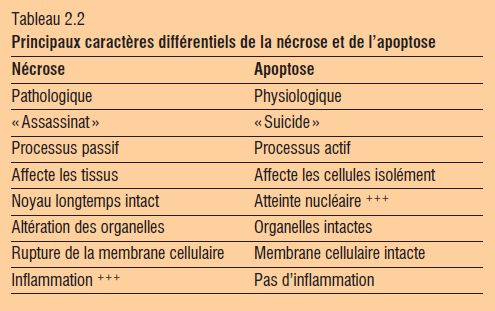
Apoptose
L’apoptose est une forme de mort cellulaire et s’oppose presque en tous points à la nécrose (tableau 2.2).
Définition
L’apoptose est la mort cellulaire programmée.
Nommée ainsi d’après le terme grec « tombé » elle fut individualisée en 1972 pour qualifier la mort cellulaire destinée à éliminer des cellules indésirables.
Elle concerne des cellules isolées, et non pas des groupes de cellules comme dans la nécrose.
La mort cellulaire programmée est le plus souvent un mécanisme physiologique de « suicide » cellulaire essentiel au développement, à la maturation, et au renouvellement normal des tissus.
C’est un processus actif nécessitant des signaux d’activation, une transduction de signal, l’expression de gènes et une synthèse protéique.
Elle peut être induite ou prévenue par l’adjonction ou la suppression de stimuli particuliers.
2
.
3
.
1
-
Circonstances d'apparition
-
Physiologique :
- au cours de l’organogénèse (neurones) et de la croissance (involution thymique) ;
- au cours du développement de l’immunité (destruction des lymphocytes T autoréactifs) ;
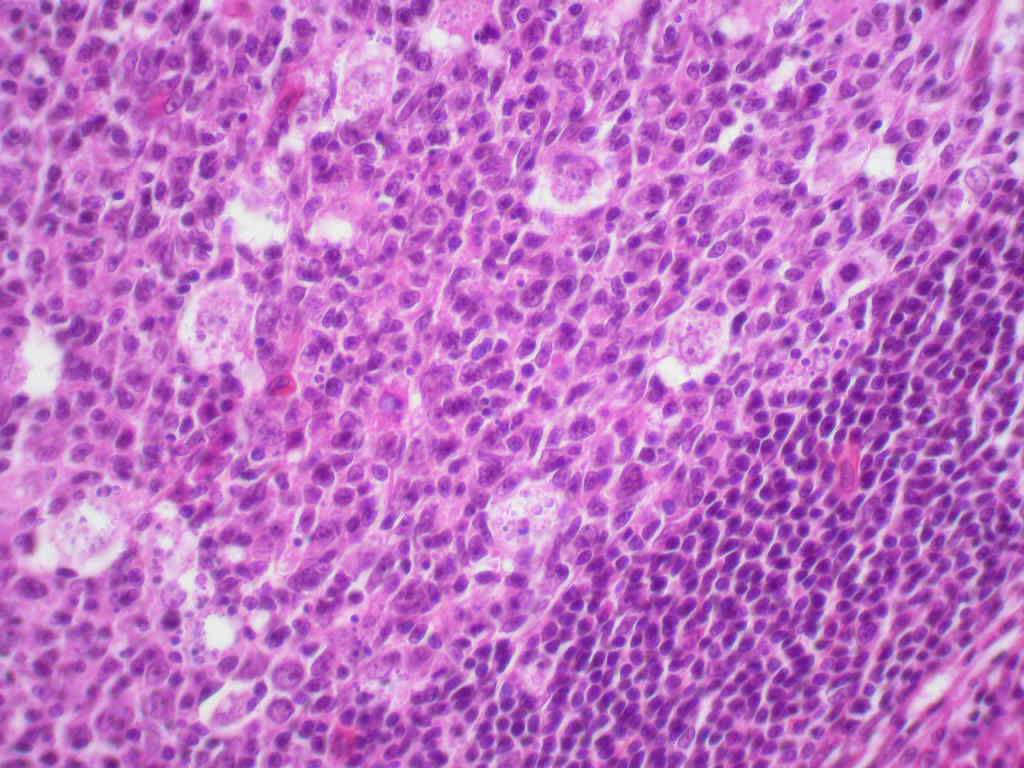
- comme mécanisme d’homéostasie dans des tissus où le renouvellement cellulaire est permanent comme les cellules de l’épithélium gastro-intestinal, et les centres germinatifs des ganglions (figure 2.13) ;
- au cours de l’involution hormono-dépendante chez l’adulte : destruction des cellules endométriales au cours du cycle, régression des lobules mammaires après sevrage ;
- au cours du vieillissement.
-
Processus pathologiques :
- elle intéresse alors des cellules lésées ou des cellules reconnues comme étrangères ou tumorales par les lymphocytes T cytotoxiques ou NK, comme au cours du rejet de greffe, des hépatites virales ;
- elle peut être induite par des stimuli qui à petites doses entraînent une apoptose, alors qu’à doses élevées ils induisent une nécrose : chaleur, irradiations, chimiothérapies anticancéreuses ;
- elle est observée dans certains organes lors d’une obstruction canalaire, par exemple dans le pancréas, la parotide, le rein.
Physiopathologie
L’apoptose passe par plusieurs étapes clés. De nombreux moyens de déclenchement sont possibles faisant intervenir des molécules de la famille TNF (Tumor necrosis factor). Puis il y a un stade de contrôle avec l’intervention de systèmes de régulations positifs et négatifs, comportant notamment la famille protéique Bcl-2 (oncogène, inhibiteur de l’apoptose), le gène TP53 (inducteur le l’apoptose, suppresseur de tumeur). Enfin, il y a un stade d’exécution mettant en jeu l’activité des caspases, capables de protéolyse terminale aboutissant à une fragmentation nucléaire rapide et régulière en 300 000 puis 50 000 paires de bases, puis en fragments qui sont des multiples d’un oligonucléosome de 180 paires de bases.
Une dysrégulation de l’apoptose est ainsi considérée comme étant à l’origine de nombreuses maladies :
- celles associées à une inhibition de l’apoptose et à une augmentation de la survie cellulaire, où un taux trop bas d’apoptose permet la survie de cellules anormales, dans certains cancers où existe une mutation du gène TP53 par exemple, et certaines maladies auto-immunes, si les lymphocytes autoréactifs ne sont pas supprimés après une réponse immunitaire ;
- celles associées à une apoptose excessive, caractérisées par une perte de cellules normales ou protectrices comme la déplétion lymphocytaire viro-induite du VIH, certaines maladies neurodégénératives (amyotrophie spinale).
2
.
3
.
2
-
Aspects de l'apoptose
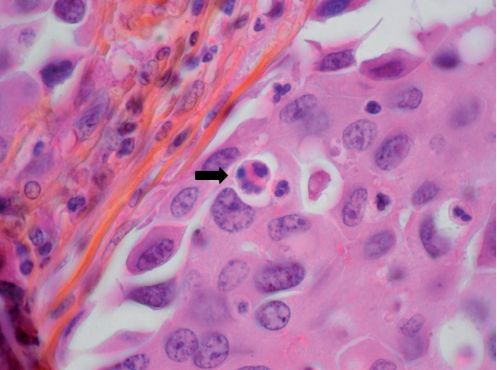
La cellule apoptotique apparaît en microscopie optique comme une cellule isolée des autres, rétractée, avec un cytoplasme éosinophile, comportant des fragments de chromatine nucléaire dense. À un stade débutant, la chromatine est condensée en périphérie du noyau. L’apoptose est quelquefois difficile à identifier car elle concerne des cellules isolées, ou très peu nombreuses, et n’induit pas de réaction inflammatoire (figure 2.14).
Les lésions sont mieux visibles, surtout aux stades précoces en microscopie électronique. La chromatine est condensée en périphérie du noyau, le nucléole est le siège d’une désintégration fibrillaire, des granulations osmiophiles apparaissent dans le nucléoplasme. Les organites intracytoplasmiques sont conservés, et les membranes restent très longtemps intactes, au contraire de la nécrose. Les structures de la surface cellulaire disparaissent, par exemple les micro-villosités de sorte que la cellule présente des contours lisses et s’isole des cellules voisines. Le volume cellulaire diminue.
Finalement le noyau et la cellule elle-même se clivent en plusieurs fragments, entourés de membrane plasmique : ce sont les corps apoptotiques.
2
.
3
.
3
-
Evolution
Les cellules apoptotiques ainsi que les corps apoptotiques sont phagocytés par des macrophages ou par des cellules vivantes voisines. La cellule en apoptose est alors progressivement dégradée. Lorsque les cellules apoptotiques siègent dans un épithélium bordant une lumière elles peuvent aussi être éliminées dans la lumière (épithélium intestinal, etc.).
Mise en évidence sur coupes de tissus
Plusieurs méthodes de détection in situ peuvent être utilisées : immunohistochimie, pour mettre en évidence la caspase 3 activée, et hybridation in situ pour la détection des terminaisons 3’OH au niveau des brisures internucléosomales de l’ADN (méthodes ISEL, In situ end labelling et TUNEL, TdT-mediated dUTP-biotin nick end labelling).
4/8