2 - La matériovigilance
2 . 1 - Définition
La matériovigilance a pour objet la surveillance des incidents ou des risques d’incidents pouvant résulter de l’utilisation de dispositifs médicaux mis sur le marché. (Art. R.665-48 du code de la santé publique).
Elle accompagne la mise en place des nouvelles règles de mise sur le marché des dispositifs médicaux, adoptées par les états membres de l’Union Européenne (le marquage CE) selon des directives européennes :
- directive n° 90/385 CEE du 20 juin 1990 relative aux dispositifs médicaux implantables actifs, d’application obligatoire depuis le 1er janvier 1995,
- directive n° 93/42 CEE du 14 juin 1993 relative aux autres dispositifs médicaux, applicable depuis le 1er janvier 1995, obligatoire depuis le 14 juin 1998
La matériovigilance comporte le signalement, l'enregistrement, l'évaluation et l'exploitation des informations signalées dans un but de prévention (Art. R.665-48 du CSP).
Elle a pour objectif d'éviter que ne se reproduisent des incidents et risques d'incidents graves (définis à l'article L.5242-2) mettant en cause des dispositifs médicaux, en prenant les mesures préventives et /ou correctives appropriées.
Elle comprend également la réalisation d’études et travaux concernant la sécurité d'utilisation des dispositifs médicaux et la réalisation ainsi que le suivi des actions correctives décidées.
2 . 2 - Notion de dispositif médical
Un dispositif médical est défini par la directive européenne (93/42/CEE du 14 juin 1993 relative aux dispositifs médicaux) comme tout instrument, appareil, équipement, matière ou autre article, utilisé seul ou en association, y compris le logiciel destiné par son fabricant à être utilisé chez l’homme à des fins :
- de diagnostic, de prévention, de contrôle, de traitement ou d'atténuation d'une maladie ;
Exemples : thermomètre médical, stéthoscope etc.
- de diagnostic, de contrôle, de traitement, d'atténuation ou de compensation d'une blessure ou d'un handicap ;
Exemples : pansements, sutures résorbables ou non, etc.
- d'étude ou de remplacement ou modification de l'anatomie ou d'un processus physiologique ;
Exemples : prothèse mammaire, colles biologiques, amalgame dentaire, etc.
- de maîtrise de la conception ;
Exemples : dispositif intra-utérin, préservatif, diaphragme etc.
Le code de la Santé publique définit un dispositif médical dans l’article L5211-1 (cinquième partie, Livre II, Titre I, Chapitre I) :
« On entend par dispositif médical tout instrument, appareil, équipement, matière, produit, à l'exception des produits d'origine humaine, ou autre article utilisé seul ou en
association, y compris les accessoires et logiciels nécessaires au bon fonctionnement de celui-ci, destiné par le fabricant à être utilisé chez l'homme à des fins médicales et
dont l'action principale voulue n'est pas obtenue par des moyens pharmacologiques ou immunologiques ni par métabolisme, mais dont la fonction peut être assistée par de
tels moyens. Constitue également un dispositif médical le logiciel destiné par le fabricant à être utilisé spécifiquement à des fins diagnostiques ou thérapeutiques.
Les dispositifs médicaux qui sont conçus pour être implantés en totalité ou en partie dans le corps humain ou placés dans un orifice naturel, et qui dépendent pour leur bon
fonctionnement d'une source d'énergie électrique ou de toute source d'énergie autre que celle qui est générée directement par le corps humain ou la pesanteur, sont
dénommés dispositifs médicaux implantables actifs. »
L’action principale d’un dispositif médical n’est pas obtenue par des moyens pharmacologique ou immunologique ni par métabolisme, elle est essentiellement mécanique.
La mise sur le marché des dispositifs médicaux est réalisée sous la responsabilité de leur fabricant après qu’ils y ont apposé le marquage CE, témoin de la conformité aux exigences essentielles de santé et de sécurité fixées par les directives européennes.
L’AFSSAPS comme les autres autorités en charge de ces dispositifs, intervient, a posteriori, pour surveiller le marché, c’est-à-dire s’assurer de la conformité aux exigences de santé et de sécurité des dispositifs mis sur le marché sur le territoire national.
2 . 3 - Organisation de la matériovigilance
(articles R. 5212-1 à R. 5212-35 du Code de la santé publique)
La matériovigilance est mise en œuvre dès qu’un dispositif médical s’avère ou risque d’être dangereux.
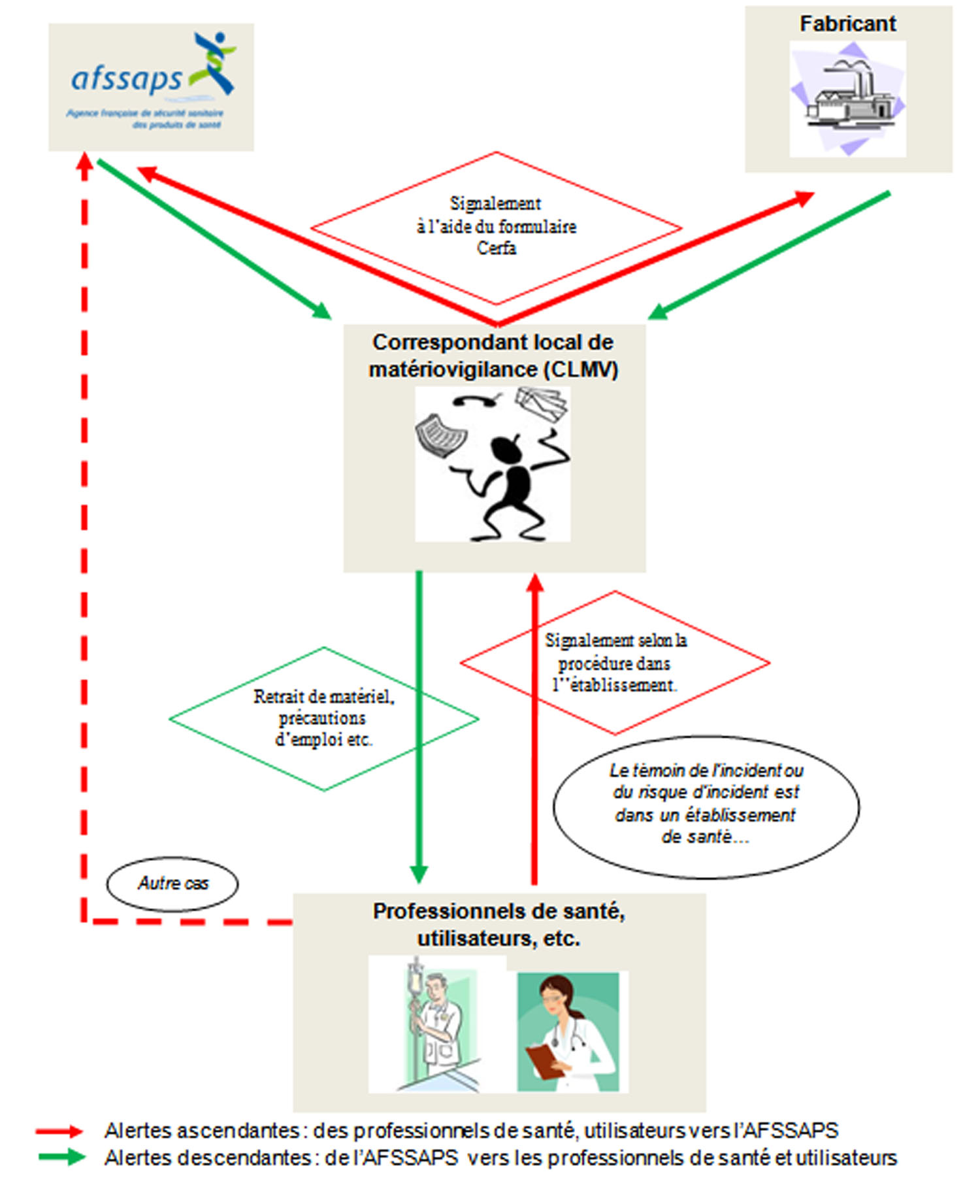
Le système national de matériovigilance (article R665-51 du code de la santé publique) comporte :
-
Un échelon national :
- L’AFSSAPS,
- la commission nationale de matériovigilance (CNM) instituée à l'article R. 665-54 et ses sous-commissions techniques prévues à l'article R. 665-55,
-
Un échelon local :
- les correspondants locaux de matériovigilance des établissements de santé mentionnés à l'article R. 665-59,
- les personnes tenues de signaler les incidents ou risques d'incidents dont elles ont connaissance.
L’AFSSAPS est l’autorité compétente elle peut intervenir de 2 façons :
- soit à la suite d’un signalement d’incident ou de risque d’incident provenant d’un déclarant. L’AFSSAPS va évaluer les informations communiquées et apporter la réponse appropriée aux faits signalés : il s’agit des alertes ascendantes.
- soit à sa propre initiative lorsqu’elle juge que la sécurité sanitaire est en cause, à la suite du recueil d’informations comme des articles de presse, d’informations obtenues dans le cadre des conditions de mise sur le marché d’un dispositif marqué CE, des conclusions d’un dossier de matériovigilance nécessitant l’engagement d’investigations dans un autre secteur,… : il s’agit des alertes descendantes.
La commission nationale de matériovigilance (CNM) a pour mission :
- d'évaluer les informations sur les incidents et les risques d'incidents mettant en cause des dispositifs médicaux,
- de donner un avis sur les mesures à prendre pour faire cesser ces incidents,
- de proposer des enquêtes et des travaux utiles à l'exercice de la matériovigilance.