5 - Hypoglycémies en dehors du diabète
Le diagnostic positif est souvent délicat : on a rarement la chance d’observer un épisode clinique et de pouvoir simultanément mesurer la glycémie par une méthode fiable (glycémie sur plasma veineux, et non pas glycémie capillaire au doigt). C’est ce que l’on cherche à obtenir au cours de l’épreuve de jeûne de 72 h, obligatoirement conduite en milieu hospitalier, au mieux dans un service spécialisé.
Dans tous les cas, avant d’envisager une épreuve de jeûne, il est capital d’éliminer les étiologies évidentes d’hypoglycémie que sont :
- l’alcoolisme (alcoolisation aiguë, souvent massive, à jeun) ;
- l’insuffisance rénale et hépatique sévère ;
- l’insuffisance surrénale ou corticotrope (test au Synacthène®) ;
- les médicaments (cf. infra).
5 . 1 - Diagnostic positif des hypoglycémies
Lorsqu’il n’a pas été possible d’obtenir chez un patient symptomatique un dosage fiable de la glycémie, il faut envisager une épreuve de jeûne. Lorsqu’elle est bien conduite en milieu spécialisé pendant 72 heures, elle apporte le diagnostic dans 99 % des cas, sans qu’il soit nécessaire de recourir à d’autres tests diagnostiques. En pratique, plus de 70 % des patients ayant un insulinome font une hypoglycémie dès les 24 premières heures de l’épreuve de jeûne.
Il s’agit d’un jeûne total, seule l’ingestion d’eau et de bouillons légers est autorisée ; le malade ne doit pas sortir de sa chambre, porte un cathéter qui permet les prélèvements et la perfusion immédiate de glucose en cas de trouble de conscience. Le laboratoire de biochimie est alerté, et doit pouvoir rendre les résultats de glycémie veineuse en quelques minutes.
L’épreuve est arrêtée dès que le patient a des symptômes de neuroglucopénie, après que les prélèvements nécessaires ont été réalisés. Le seuil de glycémie habituellement requis pour arrêter l’épreuve est de 0,40 g/L (2,2 mmol/L).
5 . 2 - Diagnostic étiologique
1. Principales causes d’hypoglycémie
Voici la liste des principales causes d’hypoglycémie :
- l’alcool ;
- les médicaments suivants :
- insuline et analogues de l’insuline,
- sulfonylurées et répaglinide,
- quinine et dérivés (quinidine, disopyramide),
- pentamidine (forme injectable),
- salicylés (à forte dose, essentiellement chez l’enfant),
- phénylbutazone,
- ritodrine et bêta-2 agonistes (à l’arrêt trop brutal de la perfusion),
- cibenzoline,
- dextropropoxyphène ;
- des toxiques (Vacor® ou « mort au rat », le fruit de l’Ackee d’Afrique ou de Jamaïque, etc.) ;
- l’insuffisance hépatique sévère et les anomalies congénitales ou acquises de la néoglucogenèse, dont :
- l’insuffisance rénale,
- la malnutrition sévère ;
- le déficit des hormones de contre-régulation :
- insuffisance surrénalienne ou corticotrope (surtout chez l’enfant),
- déficit isolé en hormone de croissance, rare, essentiellement chez l’enfant,
- insuffisance antéhypophysaire (surtout chez l’enfant) ;
- l’acidose lactique, l’accès pernicieux palustre (etc.) ;
- les hypoglycémies tumorales :
- sécrétion d’insuline (insulinome +++, rarissimes tumeurs extrapancréatiques),
- sécrétion du facteur apparenté à l’insuline, l’IGF2, qui est le fait de tumeurs mésenchymateuses, souvent très volumineuses, plus rarement de carcinomes hépatocellulaires,
- sécrétion d’anticorps anti-insuline (rarissime myélome) ;
- l’hypersécrétion non tumorale d’insuline (nésidioblastose, rarissime) ;
- de rarissimes hypoglycémies auto-immunes, avec autoanticorps anti-insuline.
2. Insulinome (+++)
L’insulinome est la première cause tumorale d’hypoglycémie, la plus fréquente des tumeurs endocrines fonctionnelles du pancréas, mais c’est une tumeur rare : incidence de moins de 5 cas par million et par an.
L’insulinome est souvent isolé, mais s’inscrit parfois (5 % des cas) dans le contexte d’une néoplasie endocrinienne multiple de type 1 (NEM1), où il est alors volontiers multiple.
C’est habituellement une tumeur bénigne, maligne dans 10 % des cas (la malignité ne peut être affirmée que par la survenue de métastases).
C’est le plus souvent une tumeur de petite taille (90 % font moins de 2 cm et 30 % moins de 1 cm), ce qui pose des problèmes pour la repérer avec les moyens morphologiques dont on dispose.
a. Clinique
L’insulinome donne des épisodes d’hypoglycémie, parfois très épisodiques, chez des adultes souvent jeunes et bien portants. Les signes de neuroglucopénie sont au premier plan, souvent mal rapportés par le patient. L’interrogatoire doit les rechercher. Le diagnostic est ainsi souvent retardé, même chez des patients ayant de fréquents épisodes, et certains patients reçoivent pendant plusieurs années des diagnostics neurologiques ou psychiatriques divers.
Les épisodes surviennent plus volontiers à jeun, ou à l’effort, mais ça n’est pas un critère absolu ; la répétition des épisodes s’accompagne d’une prise de poids.
b. Diagnostic
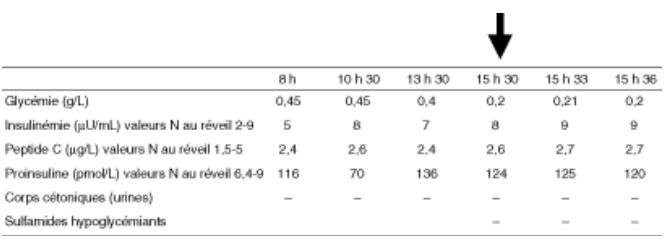
Le diagnostic de sécrétion tumorale d’insuline est souvent facile après l’épreuve de jeûne : l’hypoglycémie s’accompagne d’une concentration mesurable (non nulle) d’insuline et de peptide C. Lorsqu’on la dose, la concentration de pro-insuline est souvent plus élevée que celle d’insuline. La figure 11.1 présente les paramètres biologiques d’une épreuve de jeûne typique d’insulinome.
Dernier repas pris la veille au soir à 20 heures.
Les glycémies basses de début d’épreuve ne suffisaient pas au diagnostic, en l’absence de symptômes. Symptômes de neuroglucopénie, avec glycémie basse à 15 heures (pâleur, lenteur d’idéation), conduisant à l’arrêt immédiat de l’épreuve, et à la correction immédiate des symptômes lors du resucrage oral. L’insulinémie est dans une fourchette normale mais totalement inadaptée à la glycémie : elle devrait être indosable pour une telle glycémie. Le peptide C dosable prouve que l’hypoglycémie n’est pas due à une injection d’insuline. L’absence de sulfamides hypoglycémiants dans le plasma prouve que l’hypoglycémie n’est pas la conséquence de la prise de sulfonylurée. Comme c’est souvent le cas, l’élévation de la pro-insuline est disproportionnée par rapport à celle de l’insuline.
– Diagnostic différentiel (+++)
Deux diagnostics dominent le diagnostic différentiel : prise cachée d’insuline et prise cachée de sulfonylurées. De telles prises cachées (hypoglycémies « factices ») sont souvent le fait de patients proches du milieu médical ou d’un diabétique, et qui ont parfois des antécédents psychiatriques. Exceptionnellement l’administration cachée est le fait d’un tiers, dans un but criminel, ou dans le cadre d’un syndrome de Münchhausen « par procuration ».
Chez les patients qui ont parfois des prises cachées d’insuline, lors de l’épreuve de jeûne, le tableau biologique est le suivant : hypoglycémie avec une insuline mesurable, mais le peptide C et la pro-insuline sont indosables.
Chez les patients qui ont des prises cachées de sulfonylurées, le tableau biologique est le suivant : hypoglycémie avec une insuline et un peptide C mesurables, similaire donc au tableau de l’insulinome. Il est donc de règle de doser les principales sulfonylurées, en fin d’épreuve de jeûne, à la moindre suspicion.
De manière très exceptionnelle chez l’adulte, on peut trouver une nésidioblastose, conséquence d’une altération diffuse de la fonction des cellules bêta, observée essentiellement chez le nourrisson. Le tableau biologique est similaire à celui de l’insulinome, mais « classiquement » les hypoglycémies surviennent après les repas, plutôt qu’à jeun, et l’épreuve de jeûne peut être négative.
– Diagnostic topographique
C’est l’étape difficile du diagnostic chez des patients dont les tumeurs sont de petite taille et dans un organe profond. Il est néanmoins nécessaire, avant de se lancer dans une chirurgie difficile, de pouvoir localiser la tumeur et de pouvoir affirmer qu’elle est unique.
Deux examens dominent cette étape et doivent être combinés chez tous les patients (voir aussi item 5) :
- l’échoendoscopie, qui n’a de valeur que si elle est faite par un médecin habitué à ce diagnostic (figure 11.2) ;
- le scanner en coupe fine du pancréas, avec coupes en phase artérielle précoce (photo 30).
L’échographie habituelle est le plus souvent sans intérêt. L’IRM peut aider à la localisation de l’insulinome. La scintigraphie à la somatostatine manque de sensibilité et n’a d’intérêt que si elle est positive. Dernièrement, la scintigraphie des récepteurs du GLP1 a montré des résultats prometteurs dans la localisation et la détection peropératoire des insulinomes ; elle n’est actuellement pas disponible en France.
Les chirurgiens complètent les données de l’échoendoscopie et du scanner en coupe fine par la palpation peropératoire voire une échographie per opératoire.
L’échoendoscopie retrouve un insulinome de 19 mm de la face postérieure du corps du pancréas.
Cette échoendoscopie suit une première échoendoscopie faite par un médecin moins entraîné, et considérée comme normale. Cela illustre l’importance du choix du médecin qui fait l’examen. L’insulinome était bien là où l’échoendoscopie l’avait visualisé, et de la taille annoncée.
c. Traitement
Le traitement de l’insulinome repose sur l’exérèse chirurgicale de la tumeur. Assez souvent, le chirurgien peut faire une simple énucléation de la tumeur, sans pancréatectomie, sous laparoscopie.
En attendant la chirurgie, certains prescrivent du diazoxide. Les réponses aux analogues de la somatostatine sont inconstantes, avec parfois des réponses paradoxales.
Pour information
Nouvelle recommandation de la Société américaine d’endocrinologie 2009
Chez un patient ayant présenté une triade de Whipple, une glycémie <0,55g/L (spontanément ou lors d’une épreuve de jeûne) concomitante d’une insulinémie >3 mUI/L et d’un peptide C >0,6ng/mL confirme le diagnostic d’insuli nome (avec absence de prise de sulfamide et absence d’anticorps).