1
-
Stase sanguine/pathologie hémodynamique
1
.
1
-
Œdème
L’œdème est une augmentation de la quantité d’eau dans les espaces extra-vasculaires.
Aspect macroscopique : les tissus et organes œdémateux sont mous et pâles : après incision, ils peuvent laisser sourdre un écoulement de liquide légèrement rosé. Les œdèmes prédominent dans les parties déclives (œdèmes des chevilles). Le tissu garde parfois l’empreinte du doigt à la pression (signe du godet). L’œdème peut intéresser les cavités naturelles de l’organisme : séreuses (épanchement pleural, ascite), cavités articulaires (hydarthrose). L’anasarque désigne un œdème généralisé.
Aspect microscopique : les anomalies microscopiques sont assez subtiles à identifier. Le tissu est infiltré par une sérosité pâle, très faiblement éosinophile, écartant les uns des autres les éléments constitutifs normaux (cellules, fibres).
Physiopathologie : on distingue deux types d’œdèmes, selon qu’ils sont liés à des phénomènes hémodynamiques ou à un processus inflammatoire. Les principales causes des œdèmes sont résumées dans le tableau 4.1.
Les œdèmes hémodynamiques ou transsudats sont pauvres en protéines plasmatiques.
Ils peuvent résulter de plusieurs mécanismes (figure 4.1) :
- augmentation de la pression hydrostatique dans le secteur veineux : soit œdème localisé par obstacle sur une veine, soit œdème généralisé par insuffisance cardiaque globale (voir plus loin le paragraphe dédié à la congestion passive) ;
- diminution de la pression oncotique des protéines plasmatiques, dans les états d’hypoprotidémie (malnutrition sévère, protéinurie massive, insuffisance hépatique grave) ;
- rétention hydro-sodée (insuffisance rénale) ;
- obstacle au drainage lymphatique (éléphantiasis).
Les œdèmes lésionnels ou exsudats sont riches en protéines plasmatiques.
Ils sont dus à une augmentation de la perméabilité endothéliale (phase initiale de l’inflammation) : œdème lésionnel pulmonaire au cours du syndrome de détresse respiratoire aiguë (SDRA) de l’adulte, par exemple.
Conséquences des œdèmes : elles varient selon le siège et l’intensité de l’œdème :
- compression gênant le fonctionnement d’un organe : trouble de la fonction ventriculaire au cours d’un hydropéricarde (tamponnade) ;
- réaction inflammatoire (et surinfection) : complication possible des œdèmes prolongés ;
- décès, si l’œdème se développe dans une zone dangereuse : œdème aigu de la glotte, du poumon (OAP), œdème cérébral.
1
.
2
-
Congestion
La congestion est une augmentation de la quantité de sang contenue dans des vaisseaux qui se dilatent.
La congestion peut être active ou passive (figure 4.2). Beaucoup de causes de congestion sont aussi des causes d’œdèmes, ce qui explique que les deux anomalies soient souvent associées.
1
.
2
.
1
-
Congestion active
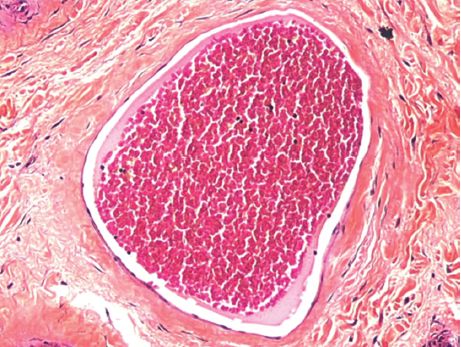
La congestion active est la conséquence d’une augmentation de l’apport de sang artériel (hyperhémie) par vasodilatation active des artérioles de la microcirculation (figure 4.3).
Elle se traduit par une rougeur et une chaleur locales. Les organes touchés sont de poids augmenté.
Elle s’observe par mécanisme nerveux réflexe, par adaptation lors d’une sollicitation fonctionnelle accrue (muscle en exercice), lors de la phase initiale d’une inflammation et par la mise en jeu de médiateurs chimiques.
1
.
2
.
2
-
Congestion passive
La congestion passive est la conséquence d’un ralentissement du drainage sanguin veineux (stase).
Elle s’accompagne d’une dilatation passive des veines et capillaires et d’une diminution du débit sanguin. Les tissus souffrent d’hypoxie : les cellules endothéliales sont les premières altérées, ce qui, associé à une augmentation locale de la pression hydrostatique, produit un œdème. Les organes sont froids, bleu violacé (= cyanose par désaturation de l’hémoglobine), de poids augmenté.
La congestion passive peut être localisée, d’origine veineuse, liée à une stase, à une oblitération (thrombose) ou à une compression veineuse.
Elle peut aussi être généralisée, due à une insuffisance cardiaque. Les conséquences sont différentes selon le type d’insuffisance cardiaque.
Congestion liée à une insuffisance cardiaque gauche
Il s’agit d’une incapacité du cœur gauche à évacuer le sang veineux pulmonaire. Elle entraîne une élévation des pressions dans la circulation veineuse pulmonaire et des conséquences pathologiques prédominant au niveau du poumon : « poumon cardiaque ».
- Si la stase est aiguë, elle entraîne un œdème aigu pulmonaire (OAP), réversible. Les poumons sont lourds, crépitants, laissant échapper à la coupe un liquide spumeux (ressemblant à de l’écume), parfois hémorragique, avec ou sans épanchement pleural. Microscopiquement, les alvéoles sont inondées par de l’œdème et parfois par des hématies, les capillaires des cloisons alvéolaires sont gorgés d’hématies.
- Si la stase devient chronique, elle aboutit à une « induration brune des poumons », irréversible. Les poumons sont fermes et de couleur brique, brunâtre. Microscopiquement, des sidérophages s’accumulent dans les alvéoles (l’hémosidérine provient de la dégradation des hématies dans les alvéoles). Puis apparaît progressivement une fibrose des cloisons alvéolaires, ralentissant les échanges gazeux, et une fibrose des parois vasculaires qui accroît l’hypertension dans la circulation pulmonaire.
Congestion liée à une insuffisance cardiaque droite ou globale
Elle entraîne une élévation des pressions dans l’oreillette droite, les veines caves et sus-hépatiques, et des conséquences pathologiques prédominant au niveau du foie : « foie cardiaque ».
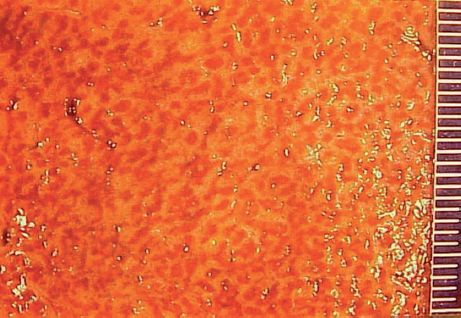
Si la stase est aiguë, le foie est gros, lisse, ferme, rouge sombre, laissant s’écouler à la coupe du sang noirâtre par les veines sus-hépatiques dilatées. Les tranches de section montrent une surface de coupe bigarrée (« foie muscade ») : un réseau rougeâtre se détache sur un fond jaune (figure 4.4). Microscopiquement, ce réseau correspond à une dilatation des veines et des capillaires centro-lobulaires. Si la stase est importante, l’hypoxie altère les hépatocytes centro-lobulaires, entraînant une stéatose puis une nécrose des hépatocytes. Ces lésions hépatocytaires peuvent confluer d’une zone centro-lobulaire à une autre, mais respectent les zones péri-portales mieux oxygénées (car recevant le sang de l’artère hépatique). Les lésions régressent rapidement avec le traitement de l’insuffisance cardiaque : le foie retrouve un volume normal, tout au moins jusqu’à l’épisode suivant de décompensation (« foie accordéon ») et les pertes hépatocytaires sont remplacées par la régénération hépatocytaire (division des hépatocytes sains).
Si la stase devient chronique, apparaît une fibrose systématisée de la paroi des veines et capillaires centro-lobulaires, puis la fibrose devient mutilante, remplaçant les zones de nécrose hépatocytaire et englobant des dépôts d’hémosidérine. Au maximum, les zones de fibrose sont confluentes et entourent les territoires péri-portaux résiduels : c’est la « cirrhose cardiaque », rare aujourd’hui du fait d’un traitement plus précoce et efficace des insuffisances cardiaques.
Remarque
Des lésions hépatiques similaires au foie cardiaque peuvent se produire en cas d’obstacle sur la circulation veineuse sus-hépatique, au cours du syndrome de Budd-Chiari (thrombose des gros troncs veineux sus-hépatiques), ou de la maladie veino-occlusive (fibrose sténosante et oblitérante de la paroi des petites veines sus-hépatiques centro-lobulaires).
1
.
3
-
Hémorragie
L’hémorragie est une issue de sang hors des cavités vasculaires.
- Hémorragie artérielle : sang rouge vif, s’écoulant de manière saccadée.
- Hémorragie veineuse : sang rouge sombre, s’écoulant de manière continue.
- Hémorragie capillaire : en nappes (par érythrodiapédèse).
Les circonstances étiologiques sont multiples
-
Rupture des vaisseaux ou du cœur : traumatisme externe, rupture d’une paroi fragilisée par une pathologie antérieure (anévrisme artériel), rupture du myocarde par nécrose ischémique (infarctus), destruction d’une paroi artérielle par un processus pathologique extrinsèque (ulcère gastrique, tumeur).
-
Érythrodiapédèse au travers de parois capillaires altérées : lésions de l’endothélium par des toxines bactériennes (au cours de septicémies) ou à l’occasion de coagulopathies de consommation (lors de divers états de choc) ou au cours de certaines inflammations localisées (dites « hémorragiques »).
Types anatomiques des hémorragies
-
Hémorragies extériorisées (externes) : hématémèse, méléna, rectorragies, épistaxis, hémoptysie, plaie cutanée.
-
Hémorragies collectées dans une cavité naturelle (hémothorax, hémopéricarde, hémopéritoine, hémosalpinx).
-
Hémorragies intratissulaires : hématomes (collection sanguine assez importante et bien limitée), hémorragie interstitielle (ecchymose, purpura, pétéchies).
Évolution des hémorragies localisées
- Les hémorragies tissulaires peu étendues évoluent progressivement vers la résorption et la guérison, avec réaction inflammatoire et dégradation locale de l’hémoglobine : hémosidérine et autres pigments dérivés de l’hème (« biligénie locale », expliquant le passage successif des ecchymoses par différentes couleurs). Les macrophages se chargent de pigment hémosidérinique (sidérophages).
- Si l’hémorragie, abondante, s’est accompagnée d’une nécrose tissulaire : développement d’une réaction inflammatoire, aboutissant à un tissu fibreux cicatriciel tatoué d’hémosidérine, parfois calcifié.
- En cas d’hématome volumineux, la détersion est souvent incomplète : il se produit alors un enkystement, on parle d’hématome enkysté. Cet hématome est une coque fibreuse entourant du sang dégradé (liquide citrin, teinté d’hémosidérine et renfermant des cristaux de cholestérol). Rarement, peut survenir une surinfection avec suppuration.
- Dans une cavité séreuse, des dépôts de fibrine vont s’organiser en un tissu fibreux, épaississant les séreuses et ayant tendance à donner des adhérences ou des symphyses (accolement des feuillets viscéraux et pariétaux de la séreuse).
Conséquences des hémorragies
Elles varient en fonction de leur importance et de leur siège.
-
Choc hypovolémique en cas d’hémorragie abondante et rapide.
-
Anémie ferriprive, si les hémorragies sont espacées dans le temps et lentes.
-
Destruction d’un tissu fonctionnellement vital pour l’organisme, dilacéré par l’hémorragie (hémorragie intracérébrale ou surrénalienne).
-
Compression gênant la fonction d’un viscère : hémopéricarde provoquant une insuffisance cardiaque aiguë (tamponnade), hématome extra-dural comprimant le cerveau.
1
.
4
-
État de choc
Le choc (ou collapsus cardio-vasculaire) est une défaillance circulatoire aiguë avec hypoperfusion généralisée des tissus. Il entraîne rapidement des lésions tissulaires par anoxie, initialement réversibles, mais dont la persistance aboutira à l’apparition de lésions tissulaires irréversibles et au décès.
1
.
4
.
1
-
Mécanismes des états de choc
Selon les mécanismes mis en jeu, les états de choc sont classés en :
-
choc hypovolémique, par diminution du volume sanguin : hémorragie, pertes plasmatiques des grands brûlés, pertes hydro-sodées par vomissements ou diarrhée ;
-
choc cardiogénique, par diminution du débit cardiaque : insuffisance cardiaque ; arrêt de la circulation cardiaque par embolie pulmonaire ;
-
choc par vasodilatation généralisée : choc septique, choc neurogène (accident anesthésique, traumatisme médullaire), choc anaphylactique, choc toxique.
1
.
4
.
2
-
Morphologie des lésions du choc
Il s’agit essentiellement de lésions hypoxiques, d’abord réversibles, puis irréversibles, entraînant la mort cellulaire si l’état de choc se prolonge. Certains organes sont préférentiellement touchés.
-
Système nerveux central : encéphalopathie ischémique, généralisée ou plurifocale, puis ramollissement cérébral.
-
Myocarde : ischémie puis nécrose localisée ou généralisée.
-
Muqueuse intestinale : lésions ischémiques multifocales coexistant avec des territoires sains, ulcérations de stress.
-
Reins : nécrose tubulaire aiguë : les cellules épithéliales tubulaires sont très sensibles à l’anoxie et aux toxines. Morphologiquement : nécrose des cellules des tubes, œdème interstitiel et congestion.
-
Poumons : atteinte surtout sévère dans les états de choc septiques : dommage alvéolaire diffus, responsable d’un syndrome de détresse respiratoire aiguë.
-
Foie : dans les régions centro-lobulaires, nécrose ischémique en nappe des hépatocytes, stéatose (signe d’hypoxie).
1/7