Introduction
Les tumeurs non épithéliales sont très hétérogènes et peuvent être séparées en plusieurs groupes selon leur morphologie et leur origine (histogénèse) supposée. Elles appartiennent à différents domaines de la pathologie.
1
-
Hémopathies malignes
Les hémopathies malignes sont développées à partir des cellules d’origine hématopoïétique et sont classées selon 4 lignées de différenciation : myéloïde, lymphoïde, histiocytaire/dendritique et mastocytaire. Elles se manifestent soit par une leucémie (= envahissement sanguin et médullaire) soit sur un mode tumoral (on parle alors de lymphome pour les hémopathies lymphoïdes).
En anatomie pathologique, le diagnostic d’hémopathie maligne est habituellement porté soit sur un prélèvement tissulaire d’une adénopathie ou d’une lésion tumorale (tube digestif, poumon, peau…), soit sur une biopsie réalisée lors d’un bilan d’extension (biopsie ostéo-médullaire, biopsie hépatique…), ou plus rarement sur un prélèvement liquidien (épanchement pleural, ascite, LCR…).
L’immunohistochimie est presque toujours nécessaire au diagnostic anatomopathologique des hémopathies. Elle permet habituellement de préciser l’origine ou le phénotype de la prolifération hématopoïétique. Sur les prélèvements tissulaires parvenus non fixés, il est possible de réaliser des appositions (permettant une étude cytologique), de la congélation (pour études en biologie moléculaire), de la cytogénétique ou de la cytométrie en flux, techniques qui apportent des renseignements complémentaires et sont parfois indispensables pour classer précisément la maladie (voir chapitre 1)
1
.
1
-
Hémopathies myéloïdes
Elles se développent à partir des cellules souches hématopoïétiques précurseurs de la lignée myéloïde (érythrocytaire, granuleuse et mégacaryocytaire). Elles sont le plus souvent diagnostiquées par les hémato-cytologistes, mais les pathologistes sont parfois sollicités : localisation extra-médullaire, évaluation de la fibrose et de la richesse médullaire, etc.
On rappellera ici seulement les trois principales catégories de néoplasies myéloïdes :
- Leucémies aiguës myéloblastiques (LAM).
Elles sont caractérisées par l’accumulation dans la moelle osseuse de précurseurs hématopoïétiques myéloïdes immatures, avec disparition de l’hématopoïèse normale. La classification la plus répandue (classification FAB révisée) distingue 8 catégories de LAM classées de M0 à M7 selon la maturation des cellules et la lignée de différenciation.
- Syndromes myéloprolifératifs.
Ils sont habituellement associés à la production excessive de cellules myéloïdes matures (différenciées). Les principaux syndromes myéloprolifératifs sont les suivants :
- leucémie myéloïde chronique, avec fusion des gènes BCR et ABL ;
- leucémie chronique à polynucléaires neutrophiles (sans réarrangement BCR/ABL) ;
- maladie de Vaquez ;
- thrombocythémie essentielle ;
- myélofibrose primitive.
- Syndromes myélodysplasiques
- Ils représentent un groupe d’affections clonales des précurseurs myéloïdes caractérisés par une hématopoïèse inefficace (défaut de maturation) avec cytopénie et comportent un risque de transformation en leucémie aiguë.
- anémie réfractaire ;
- anémie réfractaire sidéroblastique ;
- anémie réfractaire avec excès de blastes.
1
.
1
.
1
-
Hémopathies lymphoïdes
Plus de 80 % des hémopathies lymphoïdes dérivent de la lignée B. La classification OMS distingue les proliférations des précurseurs lymphoïdes (B ou T), les lymphomes B, les lymphomes T et NK (natural killer) et la maladie de Hodgkin.
Les lymphomes touchent souvent les ganglions lymphatiques, mais plus de la moitié des lymphomes ont une localisation initiale extra-ganglionnaire. En particulier, les lymphomes développés à partir du système lymphoïde associé aux muqueuses (MALT : mucosal associated lymphoid tissue) sont fréquents.
Certaines hémopathies lymphoïdes se présentent souvent sous forme leucémique, comme les proliférations des précurseurs lymphoïdes (= leucémies lymphoblastiques) ou la leucémie lymphoïde chronique. Mais des hémopathies malignes de même nature peuvent se présenter sous forme essentiellement tumorale, et seront alors dénommées lymphome (respectivement lymphome lymphoblastique et lymphome lymphocytique). Les lymphomes (ganglionnaires ou extra-ganglionnaires) ont un aspect macroscopique typiquement « chair de poisson » : blanc nacré, luisant, homogène (figure 11.1).
Les hémopathies lymphoïdes sont des entités d’agressivité très variable.
Les lymphomes sont classés en deux groupes principaux :
-
maladie de Hodgkin, particulière, non seulement morphologiquement mais également cliniquement ;
-
lymphomes non hodgkiniens (LNH).
Les LNH peuvent être sous-classés en plusieurs entités de pronostic et de traitement très différents en fonction de critères :
-
cytologiques : taille des cellules (petite, moyenne ou grande), aspect des noyaux ou des cytoplasmes ;
-
histologiques : architecture diffuse ou nodulaire ;
-
phénotypiques : lymphomes B ou T/NK ;
-
génotypiques : avec notamment des translocations récurrentes pouvant être mises en évidences par des techniques de biologie moléculaire ou de cytogénétique.
 Étude phénotypique et génotypique des lymphomes.
Étude phénotypique et génotypique des lymphomes.
1
.
1
.
1
.
1
-
Hémopathies lymphoïdes matures B
Il s’agit des lymphomes ou leucémies (en fonction de leur présentation plutôt tumorale ou leucémique) dérivant de cellules lymphoïdes de la lignée B.
Les lymphomes sont actuellement classés en fonction du stade de maturation des cellules dont ils dérivent.
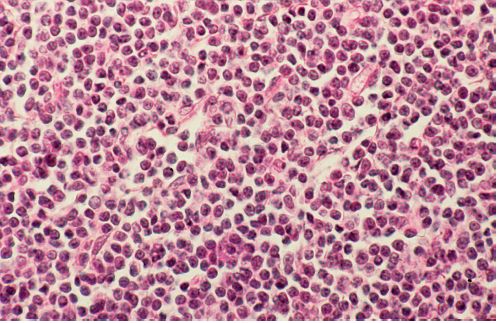
- La leucémie lymphoïde chronique (LLC) B et le lymphome lymphocytique B sont des proliférations de petits lymphocytes B matures (figure 11.2) exprimant le plus souvent le CD5 et le CD23. Ces proliférations évoluent sur un mode chronique, mais peuvent se transformer en lymphomes plus agressifs (= syndrome de Richter).
- La macroglobulinémie de Waldenström et le lymphome lymphoplasmocytaire sont souvent révélés par un pic monoclonal à IgM. Ce sont des proliférations de petites cellules B avec souvent une différentiation plasmocytaire. Leur évolution est souvent prolongée.
- Les lymphomes B de la zone marginale, qu’ils soient ganglionnaires, spléniques ou extra-ganglionnaires, sont des proliférations de petits lymphocytes B matures, généralement CD5 négatifs. Leur évolution est souvent indolente pendant de longues années. L’atteinte gastrique (lymphome du MALT de faible grade) est le plus souvent liée à une infection par Helicobacter pylori.
- Les lymphomes du manteau dérivent des cellules situées en périphérie des centres germinatifs. Ils sont liés à une translocation chromosomique t(11 ;14) qui induit une surexpression de la cycline D1, et donc une anomalie du contrôle du cycle cellulaire. Ils sont de plus mauvais pronostic que les autres lymphomes B matures.
- Les lymphomes folliculaires sont parmi les plus fréquents des lymphomes. L’atteinte ganglionnaire est d’architecture nodulaire avec un mélange de petites cellules (centrocytes) et de grandes cellules (centroblastes). La translocation chromosomique t(14 ;18) est très fréquente et responsable de la surexpression de la protéine anti-apoptotique Bcl2. Les lymphomes folliculaires peuvent se transformer en lymphomes agressifs.
- Les lymphomes diffus à grandes cellules B sont les lymphomes les plus fréquents (deux tiers des lymphomes agressifs ou « de haut grade »). Les grandes cellules (centroblastes et/ou immunoblastes) se disposent en plages diffuses.
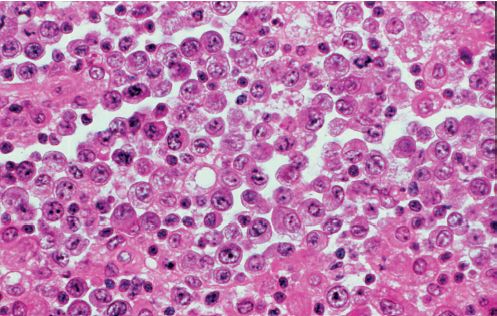
- Les lymphomes de Burkitt (figure 11.3) sont des lymphomes très agressifs surtout observés chez l’enfant et l’adulte jeune, caractérisés par une prolifération intense de cellules B de taille moyenne contenant une translocation t(8 ;14) ou plus rarement t(2 ;8) ou t(8 ;22), responsable d’une surexpression de l’oncogène MYC. Malgré leur grande agressivité, ils répondent en général favorablement à une chimiothérapie lourde.
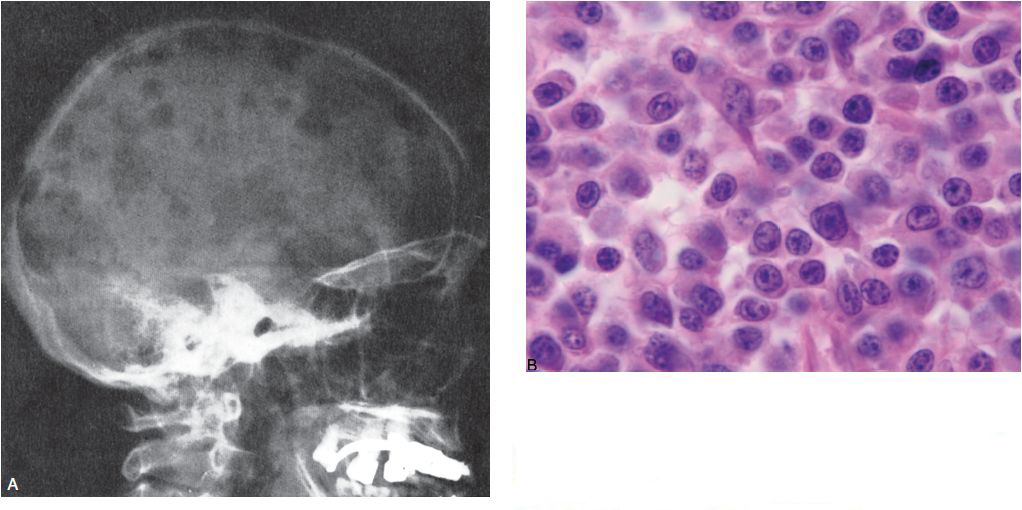
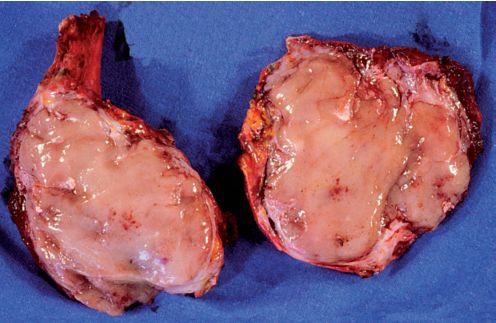
- La plus fréquente des proliférations plasmocytaires est le myélome (myélome multiple ou maladie de Kahler), qui se manifeste souvent par une atteinte osseuse lytique (figure 11.4), et/ou par un pic d’immunoglobuline monoclonale.
1
.
1
.
1
.
2
-
Hémopathies lymphoïdes matures T ou à cellules NK
Les hémopathies lymphoïdes (leucémies ou lymphomes) T ou à cellules NK sont plus rares que les lymphomes B. Elles peuvent être de localisation ganglionnaire ou assez souvent extra-ganglionnaire (ex : le mycosis fungoïdes, lymphome T cutané primitif).
1
.
1
.
1
.
3
-
Maladie de Hodgkin (lymphome de Hodgkin)
C’est une affection tumorale du tissu lymphoïde, touchant préférentiellement les sujets jeunes, caractérisée par une prolifération de cellules malignes de grande taille dont certaines, les cellules de Reed-Sternberg, sont nécessaires au diagnostic de la maladie. Ces cellules, qui ne représentent que 1 à 5 % de la masse tumorale le plus souvent, induisent l’accumulation à leur voisinage de cellules non tumorales formant le « granulome hodgkinien ». La nature des cellules de Reed-Sternberg est restée mystérieuse pendant de nombreuses années, mais il est maintenant établi qu’il s’agit de cellules lymphoïdes de la lignée B, dérivant du centre germinatif.
Le diagnostic est d’ordinaire fait sur la biopsie exérèse d’un ganglion lymphatique périphérique. Les traitements actuels permettent le plus souvent d’obtenir la guérison des patients.
1
.
1
.
1
.
4
-
Aspect histologique général
Quelle que soit la localisation, on observe une prolifération de cellules malignes associées à un stroma riche en cellules inflammatoires (le granulome hodgkinien).
La tumeur associe trois éléments :
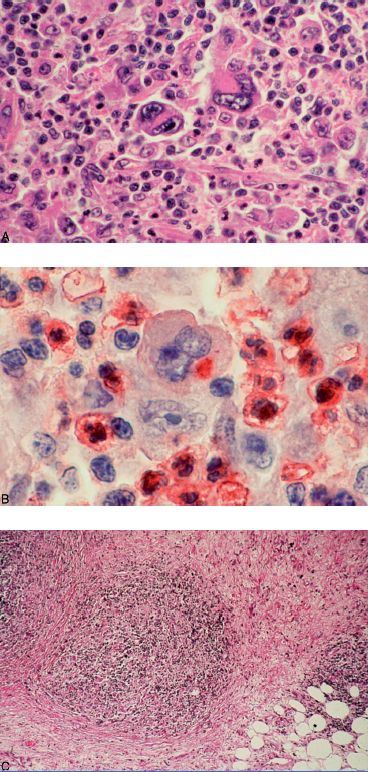
- les cellules de Reed-Sternberg, dont la détection est nécessaire au diagnostic, sont des cellules de grande taille, à noyaux multiple ou unique mais polylobé, monstrueux, dont la chromatine est abondante et irrégulièrement disposée, avec plusieurs volumineux nucléoles. Elles sont de nature lymphoïde B (figure 11.5A) ;
- les cellules de Hodgkin sont des cellules tumorales de grande taille présentant des anomalies nucléaires moins marquées que les cellules de Sternberg ;
- le granulome hodgkinien est fait de cellules normales, en proportion variée, associant des lymphocytes, des plasmocytes, des polynucléaires neutrophiles et éosinophiles, des fibroblastes, des histiocytes-macrophages (figure 11.5B). Les remaniements sont fréquents : nécrose, sclérose nodulaire (figure 11.5C).
 Localisations et stades du lymphome de Hodgkin.
Localisations et stades du lymphome de Hodgkin.
1
.
1
.
2
-
Proliférations histiocytaires
On distingue les histiocytoses langerhansiennes des autres histiocytoses.
Les histiocytoses langerhansiennes sont des proliférations de cellules de Langerhans, qui sont des leucocytes dendritiques résidents des épithéliums malpighiens et respiratoires. L’immunohistochimie est nécessaire pour confirmer l’expression du CD1a par les histiocytes tumoraux. Les histiocytoses langerhansiennes touchent plus fréquemment les enfants, mais peuvent s’observer chez l’adulte. Elles se manifestent de façon très variable par des lésions osseuses lytiques, une atteinte cutanée, pulmonaire, ganglionnaire, hépato-splénique, etc.
La plupart des histiocytoses non langerhansiennes ne sont le plus souvent pas tumorales (réactionnelles, génétiques, infectieuses).
1
.
1
.
3
-
Proliférations mastocytaires : mastocytoses
La localisation préférentielle des mastocytoses est cutanée. Les formes systémiques (généralisées) sont plus rares, et ont souvent une atteinte médullaire. Sur les biopsies cutanées, l’infiltration par les mastocytes peut être difficile à objectiver. La recherche de la métachromasie à la coloration de Giemsa ou l’immunohistochimie sont souvent nécessaires.
1
.
2
-
Tumeurs mélanocytaires
Les mélanocytes sont à l’état normal, des cellules pigmentaires responsables de la synthèse de la mélanine, situées dans l’assise basale de l’épiderme où ils s’intercalent entre les cellules basales. Le pigment mélanique est responsable de la teinte macroscopique noirâtre ou bleutée de la plupart des tumeurs mélanocytaires. Il apparaît microscopiquement comme des mottes noirâtres ou brunâtres intra et extra-cytoplasmiques.
Les tumeurs bénignes mélanocytaires sont appelées nævus nævocellulaires. En effet, on considère qu’une partie d’entre eux correspond à des hamartomes cutanés, notamment ceux présent à la naissance ou apparaissant dans la petite enfance. Elles sont définies par la prolifération de cellules rondes ou fusiformes, groupées en amas (en thèques) dans l’épiderme et/ou le derme. Ces cellules, appelées « cellules næviques », sont proches des mélanocytes par leurs caractéristiques ultrastructurales, immunophénotypiques (marquage par l’anticorps anti-protéine S100, par exemple) et fonctionnelles.
Les tumeurs malignes sont les mélanomes. Ils sont définis par la prolifération maligne de cellules à différenciation mélanocytaire. La synthèse de mélanine par les cellules tumorales explique la coloration noirâtre, souvent hétérogène, de ces tumeurs.
N.B. : il existe des nævus et des mélanomes non pigmentés, dits achromiques. Inversement, toutes les lésions cutanées pigmentées ne sont pas des tumeurs mélanocytaires.
 Lésions pigmentées non naeviques courantes.
Lésions pigmentées non naeviques courantes.
1
.
2
.
1
-
Tumeurs bénignes : nævus nævocellulaires
Cliniquement, on distingue les nævus congénitaux et les nævus acquis. Ces derniers sont les plus fréquents et apparaissent pour la plupart durant l’enfance et l’adolescence. Ce sont des lésions uniques ou multiples, de quelques millimètres de diamètre, rarement plus étendues, habituellement pigmentées, parfois pileuses, à surface lisse un peu surélevée (nævus en dôme) ou papillomateuse, en saillie sur le tégument (nævus muriforme ou tubéreux).
Microscopiquement, il s’agit d’une prolifération de cellules næviques, petites cellules arrondies au cytoplasme éosinophile peu abondant plus ou moins chargé de pigment mélanique (figure 11.6). Elles se groupent en thèques (amas arrondis d’une dizaine de cellules dont la périphérie est dépourvue de membrane basale, à la différence des massifs épithéliaux) ou forment des nappes de cellules s’étendant plus ou moins profondément dans le derme. La bénignité est affirmée sur un faisceau de critères : bonne individualisation des thèques dans la partie superficielle du derme, absence d’infiltrat inflammatoire, présence d’un gradient de maturation vertical, absence d’atypie et de mitose.
 Histologie des nævus nævocellulaires.
Histologie des nævus nævocellulaires.
1
.
2
.
2
-
Tumeurs mélanocytaires malignes : mélanomes
Les mélanomes intéressent le plus souvent la peau, rarement les muqueuses (respiratoires, digestives, génitales), la choroïde oculaire ou les structures cérébro-méningées.
Sur la peau, ces tumeurs peuvent se développer sur un nævus préexistant. Plus souvent, elles apparaissent en peau antérieurement saine. Elles sont exceptionnelles avant la puberté, plus fréquentes après 45 ans. Elles sont fréquentes dans certaines populations (race blanche, notamment australiens blonds d’origine anglaise), rares chez d’autres (japonais, race noire). L’exposition solaire et le phototype clair en sont les principaux facteurs de risque.
Les formes les plus fréquentes évoluent en 2 stades, avec une phase initiale d’extension horizontale, strictement intra-épidermique : extension lente, superficielle, centrifuge, pouvant se prolonger pendant plusieurs années, puis une phase d’invasion verticale, avec envahissement du derme et formation d’un nodule. Toutefois, dans environ 15 % des cas, le mélanome est nodulaire d’emblée, sans stade superficiel individualisable. Leur gravité et la fréquence des métastases, parfois révélatrices, doivent être soulignées. Quel que soit le type, les mélanomes sont lymphophiles : les premières métastases sont généralement ganglionnaires.
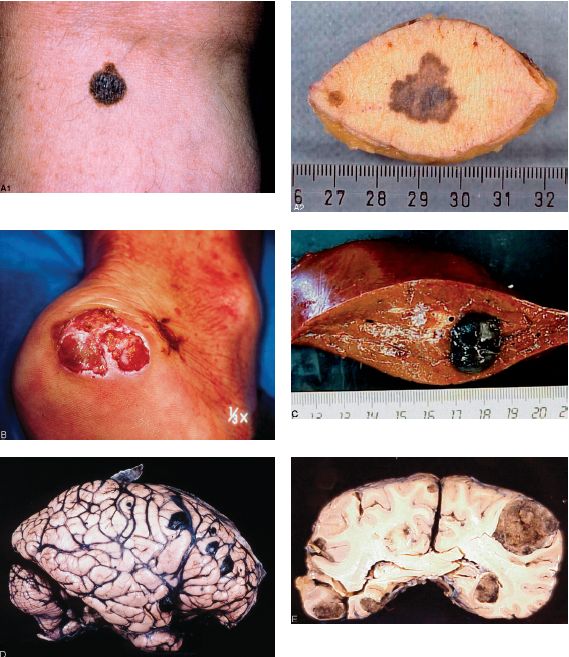
Le pronostic des mélanomes dépend de leur extension en profondeur. Le risque métastatique est d’autant plus élevé que l’invasion est profonde. En pratique, on mesure l’épaisseur de la tumeur sur la coupe en millimètres, grâce à un oculaire micrométrique gradué (indice de Breslow). Une épaisseur supérieure ou égale à 0,76 mm est un élément de mauvais pronostic. Le risque de métastases ganglionnaires, viscérales, hépatiques (figure 11.7B), pulmonaires et cérébrales (figures 11.7C, 11.7D) et d’une mortalité accrue (25 % des cas) est plus élevé.
Il est important de préciser histologiquement le niveau d’invasion du mélanome en repérant sur la coupe les cellules tumorales les plus profondément situées ( Principaux types histologiques de mélanomes et stades locorégionaux (selon Clark)).
Principaux types histologiques de mélanomes et stades locorégionaux (selon Clark)).
Il faut retenir :
- la nécessité de faire l’exérèse de toute lésion pigmentée d’apparition récente ou qui commence à se modifier, pour éviter de laisser évoluer un mélanome. Le pronostic est d’autant plus favorable que le mélanome est diagnostiqué précocement quand il a une très faible épaisseur ;
- la nécessité de préciser le type histologique d’un mélanome et d’en mesurer l’épaisseur ;
- la gravité évolutive des mélanomes, du fait de leur fort potentiel métastatique ;
- la possibilité de métastase révélatrice.
1/5






 Étude phénotypique et génotypique des lymphomes
Étude phénotypique et génotypique des lymphomes