3
-
Les enquêtes en Epidémiologie
Une fois le problème posé, comment va-t-on analyser une situation, et essayer de valider l’hypothèse ? Si l’observation par des dénombrements de routine ne suffit pas, il faut procéder à des analyses spécifiques : ce sont des enquêtes ou études épidémiologiques.
3
.
1
-
Principe des études
Le but d'une enquête est de faire un lien entre une maladie ou un état de santé, avec un facteur dit ici facteur d'exposition. Exemple : cancer du poumon et tabac, cancer de la plèvre et amiante, malformation et médicaments pendant grossesse, transfert d'un nouveau-né et facteurs de risques...
Quelquefois, on peut agir sur le facteur en le déterminant, en le contrôlant : monitoring foetal versus auscultation foetale, administration de médicaments versus placebo, maladies cardio-vasculaires en fonction de régimes alimentaires différents, exposition de toxiques dans des entreprises différentes... On parle d'expériences, ou d'expérimentations (ce mot a actuellement pour la population générale une connotation dévalorisante). Les conclusions sont alors assez aisées sur le rôle du facteur d’exposition : la différence observée ne peut être due qu’au facteur d’exposition. C'est pour cela que chaque fois que l'on peut, il faut se mettre dans cette situation (en particulier, lorsqu'il s'agit de l'essai d'un médicament).
La plupart du temps, le facteur d'exposition est aléatoire, et non contrôlé par les médecins. Toute la difficulté est alors de la causalité : le fait qu’il y ait un lien entre un facteur d’exposition (tabac chez la femme enceinte) et une maladie (le retard de croissance intra-utérin du foetus) ne veut pas dire que la tabac est LA CAUSE du RCIU. Il y a bien d’autres facteurs qui différencient les fumeuses des non-fumeuses. On les appelle FACTEURS DE CONFUSION +++. Il faut les chasser en permanence +++.
3
.
2
-
Les différents types d’enquêtes en épidémiologie
3
.
2
.
1
-
Etudes de cas : description de cas cliniques (souvent peu nombreux)
Pas très intéressant pour la compréhension des maladies…
3
.
2
.
2
-
Etudes descriptives
Enquêtes de prévalence, ou enquêtes transversales
- Elles rendent compte à un moment donné, dans un groupe donné d’une situation d’un indicateur (fréquence, distribution…). Elles ne permettent pas de poser des interprétations, mais formulent des hypothèses.
3
.
2
.
3
-
Etudes analytiques ou étiologiques
-
Etudes de cohorte
: la population est sélectionnée sur un facteur d’exposition, puis suivie suffisamment longtemps pour évaluer la maladie ou toute conséquence de l’exposition
-
Etudes cas-témoins
: la population est sélectionnée sur la maladie pour les cas, et sur l’absence de maladie pour les témoins, et l’exposition est estimée en remontant le temps.
3
.
2
.
3
.
1
-
Enquêtes de cohorte
Le principe est de suivre un groupe de personnes dont certaines sont exposées à un facteur, et d’autres non (témoins). Après un temps donné, on peut calculer le nombre de malades (ou de décès) observés au cours de la période d’étude en fonction du degré d’exposition au facteur. La direction de l’étude est prospective : de l’exposition connue vers la maladie. Dites aussi enquêtes longitudinales, ou enquêtes exposés-non-exposés.
-
Avantages : pas de biais d’exposition (connue au départ), ni de biais de maladie (analysée à l’arrivée).
-
Difficultés :
- mesure de l’exposition et mesure de la maladie
- nombre de sujets souvent grands,
- durées de suivi souvent longues (plusieurs années)
- coûts +++
- les perdus de vue sont le principal écueil +++.
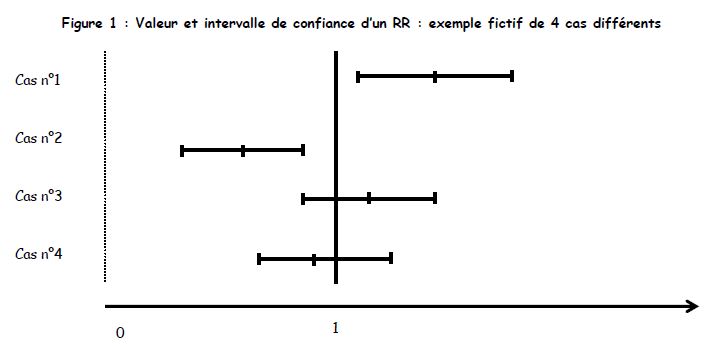
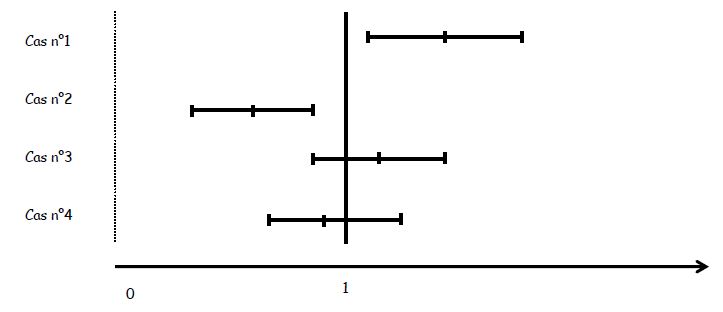
- Présentation des résultats : Risque Relatif
Intervalle de confiance du RR : lorsque une des bornes de IC à 95 % ne comprend pas 1, le RR est dit significatif au risque de 5 %.
On peut y attacher un degré de signification par la méthode du X².
-
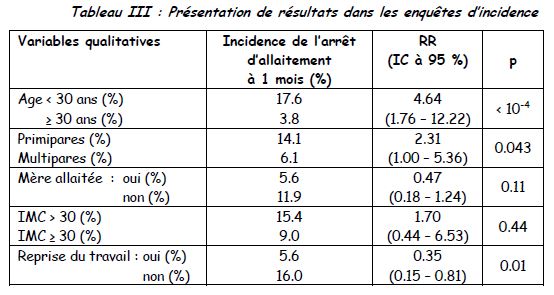
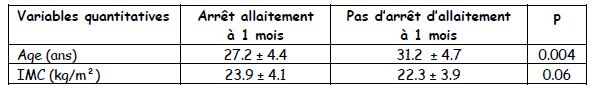
Les tableaux dans les enquêtes d’incidence : la mesure est la proportion de « malades » (critère de jugement) +++ pour les variables qualitatives et les valeurs pour les malades et les non-malades pour les variables quantitatives.
-
Exemples
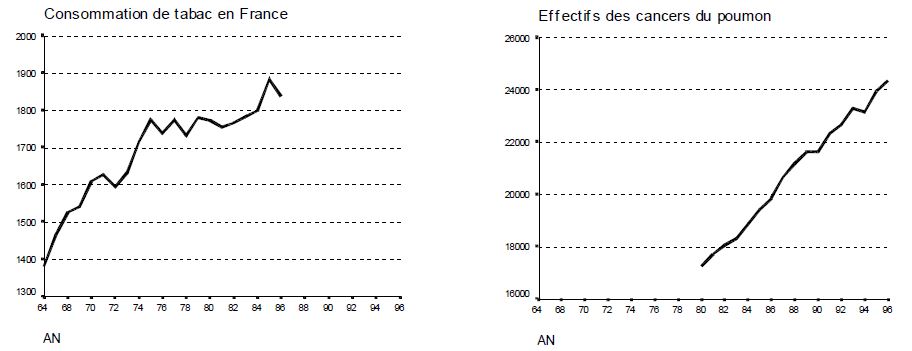
- 1951 : auprès de 40 000 médecins, suivre des individus fumeurs et des non-fumeurs. Compter l'incidence des cancers du poumon. Conclusions : les cancers sont plus nombreux chez les fumeurs. Relation causale affirmée en raison de l'importance du risque et des données biologiques en faveur du rôle carcinogène de la cigarette.
- Framingham (USA) : suivi d’une population entière pour les décès cardio-vasculaires en fonction du régime alimentaires, des facteurs de risques tels que tabac, cholestérol, tension artérielle...
- Suivi d’une population de nouveau-nés : handicaps, séquelles... Soit à partir de la naissance jusqu’à 7 ans par exemple (cohorte prospective), ou à l’âge de 7 ans en retrouvant tout le monde (cohorte historique, rétrospective)
- Transferts des nouveau-nés en Loire-Atlantique.
3
.
2
.
3
.
2
-
Enquêtes cas-témoins
On compare la fréquence de l’exposition antérieure chez des malades par rapport à des non-malades. Le recueil de l’information sur l’exposition est toujours rétrospectif : on remonte de la maladie vers l’exposition. Utilisée souvent pour les maladies rares.
-
La sélection des malades : Définitions, valeur de l’estimateur, variabilité intra-observateur, inter-observateur. Où les trouver ? Cas incidents, cas prévalents. Biais de sélection : les plus valides, les plus malades, les hommes, les femmes... qui gênera l’extension à la population générale au moment de la conclusion.
-
La sélection des témoins : C’est un groupe de sujets indemnes de la maladie, issus de la même population que les cas. Qu’est-ce qu’un bon témoin : témoins hospitaliers, témoins ambulatoires ou en population générale. 1 témoin, ou 2 témoins pour un cas.
-
Biais :
- de sélection des cas et des témoins
- de détection de la maladie
- d’observation :
- de souvenir de l’exposition : meilleur pour les malades
-
de confusion : un autre facteur non recherché peut toujours être en cause (exposition professionnelle et tabac au domicile).
-
Appariement sur un facteur (âge, sexe) : étape a priori. Pas trop de facteurs d’appariement. Les facteurs retenus ne pourront pas être étudiés. Ajustement sur un facteur au moment de l’étude statistique : étape a posteriori. Nécessite plus de sujets, mais les facteurs peuvent être étudiés.
-
Avantages : peu coûteux, rapide
- Présentation des résultats : Odds Ratio (OR)
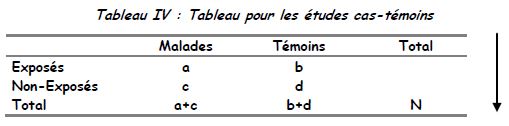
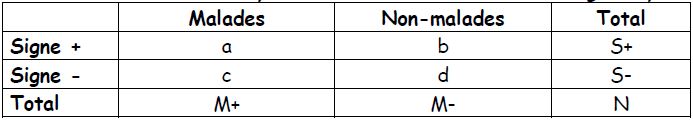
Les totaux des lignes n’ont pas des sens : cela dépend du nombre de malades et de témoins choisis (ou du nombre de témoins par cas).
Nombre d’exposés parmi les malades : a/a+c
→ Odd (ou cote) d’exposition parmi les cas : a/c
Nombre d’exposés parmi les témoins : b/b+d
→ Odd d’exposition parmi les témoins : b/d
Rapport des odds (ou des cotes) = Odds Ratio = OR = (a/c) / (b/d) = ad/bc
-
Intervalle de confiance de l’OR : lorsque l’intervalle de confiance ne comprend pas 1, l’OR est dit significativement différent de 1 au risque choisi (généralement p < 0.05). Si cet intervalle comprend 1, l’OR est dit non significatif, et son résultat peut être dû au hasard, ou à un nombre de sujets examinés trop faible (problème de puissance).
-
Conclusion des analyses :
-
la différence est significative : se méfier d’un facteur de confusion oublié (c’est un facteur associé à la maladie et à l’exposition). Ajustement sur un facteur étudié. Ajustement sur plusieurs facteurs : régression logistique
-
la différence n’est pas significative : on se tait ++++ Plusieurs réponses possibles :
- pas de lien
- puissance de l’enquête trop faible
- témoins trop exposés, trop ressemblants aux cas
- surappariement (témoins trop ressemblants aux cas) : exemple avec un tirage au sort des cas sur dossiers et sélection d’un témoin par cas avec le dossier suivant aux archives (classés dans l’ordre chronologique : surappariement sur les césariennes programmées du matin par exemple…).
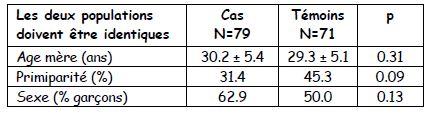
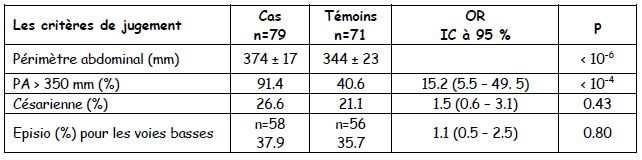
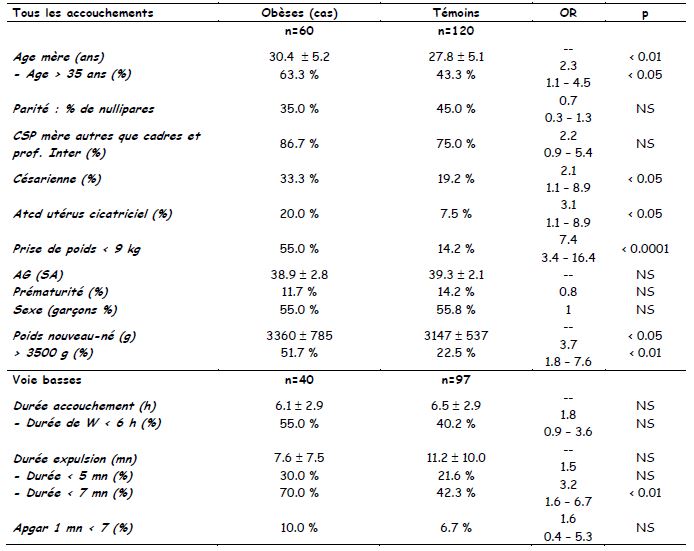
Les tableaux dans les enquêtes cas-témoins : la mesure est le taux d’exposition chez les cas et chez les témoins +++. Deux parties : le premier tableau montre que les cas et les témoins sont identiques (pas de p significatif) : pas de OR et souvent pas de « p » montré
Le deuxième tableau montre les différences recherchées avec OR (pour les variables quantitatives) et « p ».
→ Exemples
- Femmes enceintes dites « obèses » versus femmes non obèses : conséquences sur le pronostic obstétrical et foetal.
- Femmes enceintes dites « obèses » versus femmes non obèses : conséquences sur le pronostic obstétrical et foetal.
3
.
2
.
4
-
Etudes expérimentales
L’investigateur choisit le groupe de sujets soumis au facteur d’exposition (généralement un traitement), et ceux qui n’y seront pas soumis (groupe contrôle). Le critère de jugement est celui de la guérison, de la rémission, des effets secondaires. Randomisation des groupes. Double insu.
3
.
2
.
4
.
1
-
Expérience randomisée
-
Le chercheur a le contrôle complet de la nature du traitement à administrer, du moment de son utilisation, du déroulement de l'essai, du choix des personnes qui vont recevoir l'intervention.
-
Les groupes comparés sont semblables, sauf pour le traitement. Seul le traitement diffère ==> en cas de résultat différent, on peut dire que le traitement est responsable. Deux techniques :
- on tire au sort les sujets en deux groupes parallèles
- on prend le sujet comme son propre témoin. Effet période, et traitement, période de « wash-out ».
-
Technique du tirage au sort : table de nombre au hasard. Les biais des mauvais tirages au sort : par le nom, 1 sur 2, le jour de la semaine, par hôpital, par région... Ethique du tirage au sort.
-
Il y a un double insu (double aveugle) : ni le malade, ni le médecin ne savent le traitement reçu. Quelquefois, triple insu : le statisticien ne sait pas à quoi correspond le traitement A ou le traitement B. Expériences en simple insu : seul le malade ignore le traitement..
-
Exemple :
- Traitement de la crise d'asthme par le spray de Salbutamol, ou par un placebo. Technique du double aveugle : ni le médecin, ni le malade ne sait quel est le produit administré. Le placebo guérit 40 % des crises, le traitement 60 %.
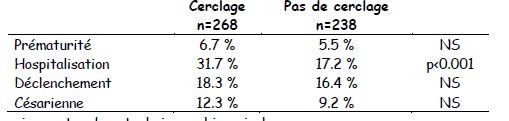
- Comparaison du cerclage du col versus sans cerclage dans les menaces d'accouchement prématuré
-
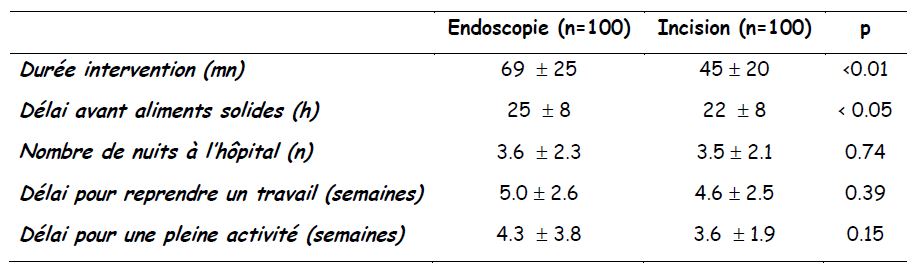
- Comparaison entre deux techniques chirurgicales...
-
Etapes : critères d’inclusion, critères de non-inclusion, population, échantillonnage, randomisation, surveillance, mesure du critère de jugement, analyse des résultats. Prévoir des analyses intermédiaires pour arrêter l’essai dès qu’un effet est mis en évidence (analyses séquentielles); le risque α doit être prévu dans ces analyses.
-
Les difficultés de l'enquête randomisée :
- elle ne répond pas au problème de l'acceptation de la technique par la population, par le médecin (impact d'un traitement, d'une intervention) : comparaison du Distilbène versus rien dans les fausses couches précoces, le monitoring foetal.
- les sujets choisis sont sélectionnés et peut-être ne sont pas les malades habituels
- l'extension à la médecine quotidienne est difficile
- Cependant, la pratique doit le plus possible reposer sur ces essais randomisés dans les phases III de l’étude d’un médicament. La lecture des revues doit privilégier ce genre d’essais. Les conférences de consensus se reposent sur les publications d’essais randomisés.
- A partir du 27 août 2006, les CCPPRB s'appellent CPP (Comités de Protection des Personnes) avec la mise en application de la nouvelle règlementation. Les avis deviennent délibératifs. Les modalités de fonctionnement du Comité ont changé, de même que sa composition.
-
La Commission Informatiques et Libertés (CNIL)
3
.
2
.
4
.
2
-
Expérience non-randomisée
Se méfier de facteurs de confusion +++
-
Enquête ici-ailleurs : dans deux centres, dans deux pays.... Se méfier des comparaisons des maternités et des hôpitaux : le recrutement des patients y est souvent très différent ++++
-
Enquête avant-après : séries chronologiques. Prudence ++++ : les malades ont pu changer +++
Principal écueil : les groupes comparés ne sont pas équivalents.
Première phase de l'étude : tableau de comparaison entre groupes ++++
3
.
2
.
5
-
Autres études
-
Stratégies diagnostiques : on compare un nouveau test avec un test de référence. Nécessité de séparer les critères en deux classes (malades et non-malades : problème de seuil). Exemple : saturation foetale et pH au cordon.
-
Etudes économiques (coût-efficacité, coût-bénéfice, coût utilité).
-
Audits
-
Principes : En 1994, l'Agence Nationale pour le Développement de l'Évaluation Médicale (ANDEM, actuellement HAS), a défini l'audit clinique ou médical ainsi : « L’audit est une méthode d'évaluation qui permet à l'aide de critères déterminés de comparer les pratiques de soins à des références admises, en vue de mesurer la qualité de ces pratiques et des résultats de soins avec l'objectif de les améliorer » . C'est une méthode d'évaluation des pratiques par comparaison à des références admises. Cette notion de référentiel est de moins en moins étrangère au monde de la santé. En effet, les professionnels de santé, soucieux de délivrer des soins appropriés, sont de plus en plus demandeurs de références. De même, les patients, mieux informés, connaissent l'existence de références, voire leur contenu. Sa principale caractéristique est de mesurer les écarts entre la pratique observée et la pratique attendue. Sa réalisation s'intègre dans une démarche d'amélioration de la qualité des soins délivrés ou peut en être le point de départ. La réalisation d'un audit clinique induira souvent des changements dans la pratique des professionnels de santé, qui devront se décliner dans un plan d'amélioration. Ainsi les audits doivent permettre :
- de mesurer l'impact des actions engagées par le service de soins,
- d’évaluer les progrès accomplis,
- de déceler des zones de dysfonctionnement ou bien des tendances à l'amélioration,
- de tirer des conséquences des dysfonctionnements ou des points forts..
-
Les différents champs des audits
- Audit des ressources : conformité des matériels, des moyens et des personnels nécessaires aux objectifs par rapport à un référentiel réglementaire ou scientifique,
- Audit des pratiques : conformité de la réalisation des procédures et des gestes par rapport à un référentiel,
- Audit des opportunités : conformité des indications de gestes par rapport à un référentiel.
- Audit de résultats : c’est une évaluation
-
Les différentes techniques des audits
- Observation de pratiques,
- Observation de dossiers,
- Entrevue,
- Auto-questionnaire.
-
Caractéristiques de l’audit : L’audit est d’abord un acte et pour qualifier cet acte, quatre éléments réunis sont nécessaires: la démarche, l’indépendance, l’objet et la finalité. L’acte d’audit s’inscrit obligatoirement dans une démarche à trois étapes :
- la recherche et la mesure de l’écart par rapport un référentiel (la norme),
- la constitution des éléments de preuve,
- la proposition des voies de redressement.
- L’acte d’audit est un acte obligatoirement indépendant. Il doit permettre à l’auditeur d’apporter aide et conseils à la personne auditée, tout en privilégiant un climat de confiance entre les parties. Il ne doit jamais se transformer en contrôle au sens d’inspection. Ainsi, l’audit est obligatoirement au profit des autres, il n’est jamais au profit de l’auditeur.
-
Méthodologie de l’audit clinique : L’Agence Nationale d'Accréditation et d'Évaluation en Santé (ANAES) a publié en juin 2003 le guide « réussir un audit clinique et son plan d’amélioration » qui propose la méthodologie à suivre dans la réalisation d’un audit clinique.
- Choix du thème, et objectifs,
- Choix du référentiel : le référentiel est constitué de l’ensemble des critères, et doit permettre de porter un jugement valide sur la pratique à évaluer. Il doit être élaboré à partir de documents récents, validés, et s’appuyer en priorité sur la réglementation et les recommandations professionnelles.
- Choix des critères : les critères sont des éléments concrets, observables et doivent être représentatifs de la qualité des soins. Ils permettent de porter un jugement sur la conformité de la pratique étudiée dans le cadre de son évaluation, et constituent la base de comparaison entre la pratique réelle et la pratique jugée optimale. Ils peuvent être classés en :
- Critères de ressources, concernant les moyens humains et matériels, les organisations,
- Critères de pratiques, faisant référence aux processus de soins, de décision, à la communication…, ce sont les plus utilisés dans l’audit clinique,
- Critères de résultats, visant à mesurer les conséquences des processus sur l’évolution clinique ou la situation des patients.
- Choix du type d’étude et de la méthode de mesure,
- Recueil des données,
- Analyse des résultats,
- Plans d'actions, d'amélioration et réévaluation.
3
.
3
-
Les biais dans les enquêtes
3
.
3
.
1
-
Biais de mesure
Difficultés de la mesure, erreur systématique de mesure, variabilité, biais de souvenir, pas rattrapable une fois l’enquête finie.
3
.
3
.
2
-
Biais de réponse, biais de non-réponse
Les malades ou les exposés répondent plus ou différemment des non-malades ou non-exposés. Les non-répondeurs sont, par hypothèse, différents des répondeurs.
3
.
3
.
3
-
Biais de mémorisation
Exemple : les mères ayant donné naissance à un enfant malformé se souvienne plus des médicaments pris pendant la grossesse que les mères sans enfant malformé. On pourra conclure, à tort, que les médicaments exposent aux malformations (ce qui, dans l’ensemble, vrai, mais ce n’est pas comme cela que l’on y arrive).
3
.
3
.
4
-
Biais de sélection
Population biaisée systématiquement par la maternité (privée, publique, CHU, CHG), par un obstétricien, par des heures d’admission, par des jours, par une période, par les sages-femmes ou les élèves sages-femmes ? Un biais de ce type gêne la généralisation au terme de l’enquête, si on s’en rend compte. On peut distinguer :
- les biais d’inclusion, et d’exclusion quand le protocole n’est pas assez précis, ou bien que les sujets sont sélectionnés sur des critères non prévus,
- les biais de détection où les malades sont détectés sur un signe lié à un autre (oestrogènes et cancer de l’endomètre),
- les biais de classement : les cas et les témoins. Problèmes des témoins : où ?, qui ?, comment ? Exemple : les témoins hospitalisés sont différents des témoins en population générale.
3
.
3
.
5
-
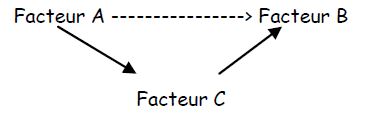
Biais de confusion (ou erreur de causalité)
Il s’agit d’y penser avant de commencer, et de les étudier au moment de l’analyse. Exemple : les femmes qui suivent une préparation à l’accouchement allaitent plus souvent que celles qui ne préparent pas → conclusion : la préparation augmente le taux d’allaitement. Cette conclusion de causalité est interdite ++++ Il pourrait y avoir un autre facteur qui explique les deux situations, c’est-à-dire que ce facteur dit facteur de confusion est causal pour l’allaitement et pour la préparation. Ce facteur existe : les femmes qui veulent allaiter sont décidées avant la grossesse, et veulent préparer l’accouchement plus que les autres. C’est un facteur psychologique qui préexiste à la décision d’allaiter et au fait de préparer l’accouchement.
Quatre exemples:
- Les « alcooliques » ont plus de cancers de poumon que les non-alcooliques. Or il n’y a pas de preuve biologique que l’alcool soit cancérigène pour les bronches. L’alcool est en fait un facteur de confusion, et l’alcoolisme est lié au tabagisme, lui-même responsable des cancers du poumon.
- RPM (Herbreteau sur 90 RPM avant 34 SA). Si tocolyse, l’accouchement avec W spontané est dans un délai moyen de 9 jours, et en l’absence de tocolyse dans un délai de 24 jours → biais de confusion qui fait conclure à l’inverse des faits.
- Dans les infections du site opératoire post-césarienne, les femmes infectées avaient plus souvent eu une antibioprophylaxie ; simplement les anesthésistes prescripteurs avaient « plus pensé » à l’ATB en cas de facteurs de risques.
- Lorsque le gynéco-obstétricien est présent à l’accouchement, les nouveau-nés vont plus mal… En fait, c’est parce que la situation est à risques que le GO est appelé.
4/12