- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Courbe ménothermique
-
2 - Les dosages hormonaux
- 2.1 - Evaluation de la fonction ovarienne
- 2.2 - Exploration de la fonction androgénique
- 2.3 - Exploration de la fonction hypothalamo-hypophysaire
- 2.4 - Dosage radio-immunologique de la prolactine plasmatique
- 2.5 - Exploration de la thyroïde
- 2.6 - L’Hormone Gonadotrophine Chorionique (hCG)
- 2.7 - Conclusion sur les dosages hormonaux
-
3 - Recherche et identification d’une infection génitale
- 3.1 - Dans quelles circonstances suspecter une infection génitale ?
- 3.2 - Moyens biologiques
-
3.3 - Principaux germes en cause et examens de laboratoire :
-
3
.
3
.
1 - Bactéries
- 3 . 3 . 1 . 1 - Gonocoque
- 3 . 3 . 1 . 2 - Infections uro-génitales à Chlamydiae trachomatis
- 3 . 3 . 1 . 3 - Lymphogranulomatose vénérienne (LGV) rectale = Maladie de Nicolas-Favre
- 3 . 3 . 1 . 4 - Mycoplasma hominis et Ureaplasma urealyticum,
- 3 . 3 . 1 . 5 - Syphilis (Treponema pallidum),
- 3 . 3 . 1 . 6 - Bacille de Ducrey (Haemophilus ducreyi) ou chancre mou
- 3 . 3 . 1 . 7 - Gardnerella vaginalis
- 3 . 3 . 1 . 8 - Bactéries anaérobies
- 3 . 3 . 2 - Virus
- 3 . 3 . 3 - Mycoses / levures :
- 3 . 3 . 4 - Parasites
- 3 . 3 . 5 - Conclusion sur le dépistage des infections génitales
-
3
.
3
.
1 - Bactéries
- 4 - Examens cytologiques : le frottis cervico uterin (FCU)
- 5 - Examens histologiques
- 6 - Examens endoscopiques
-
7 - Echographie pelvienne
- 7.1 - Introduction
- 7.2 - Modalités pratiques
- 7.3 - Echo-anatomie normale en gynécologie
-
7.4 - Indications
- 7 . 4 . 1 - Fibromes utérins
- 7 . 4 . 2 - Malformations utérovaginales
- 7 . 4 . 3 - Pathologie de l’endomètre
- 7 . 4 . 4 - Surveillance des stérilets
- 7 . 4 . 5 - Pathologie fonctionnelle de l’ovaire
- 7 . 4 . 6 - Tumeurs de l’ovaire
- 7 . 4 . 7 - Torsion de kyste
- 7 . 4 . 8 - Trompes
- 7 . 4 . 9 - Echographie interventionnelle
- 7 . 4 . 10 - Monitorage échographique de l’ovulation
- 8 - Examens radiologiques
- 9 - Autres procédés d’imagerie
- 10 - Examens complémentaires en sénologie
- 11 - Conclusion sur l’imagerie en gynecologie
- 12 - Bilan urodynamique (BUD)
- 13 - Bibliographie
- Version Enseignants
-
Version PDF

-
Contenu
- Annexes
- Votre Avis
- Ressources Enseignants
7 - Echographie pelvienne
7 . 1 - Introduction
La sonde d’échographie est souvent considérée comme la « troisième main » du gynécologue, d’autant plus que l’examen est facile, rapide, peu invasif et entraine peu d’inconfort pour la patiente. L’échographie ne doit cependant être utilisée qu’après un interrogatoire et un examen clinique attentifs, pour en identifier les objectifs. Si les techniques conventionnelles d’imagerie, incluant l’échographie pelvienne et mammaire restent à la base de toute prise en charge, l’apport de l’IRM est désormais incontestable et supplée souvent aux examens de première intention.
7 . 2 - Modalités pratiques
7 . 2 . 1 - Sondes et voie d’abord :
- Voie sus-pubienne : on utilise une sonde sectorielle de 3,5 Mhz, éventuellement de 5 Mhz chez les femmes minces.
- Voie endo-vaginale : sonde endo-vaginale à haute fréquence de 7 à 10 Mhz.
- Couplage au doppler couleur : dans la suspicion des tumeurs malignes de l’ovaire, en cas de traitement inducteur de l’ovulation, en fécondation in vitro, dans le diagnostic des torsions d’annexe, dans l’étude des tumeurs du sein et de leur récidive.
- Autres voies d’abord : périnéale pour l’étude du vagin et du col, voie rectale pour l’étude des paramètres.
7 . 2 . 2 - Installation de la patiente:
- Pour la voie sus-pubienne, la patiente est en décubitus dorsal, vessie en réplétion.
- Pour la voie endo-vaginale, la patiente est en position gynécologique, vessie vide. On préparera la sonde avec du gel échographique et un protège-sonde.
7 . 2 . 3 - Déroulement de l’examen :
- Pour la voie sus-pubienne :
- Coupe sagittale médiane : pour le repérage de la position, de l’axe et la biométrie utérine.
- Balayage transversal ascendant du vagin jusqu’au fond utérin.
- Coupes para-médianes pour le repérage des ovaires : aspect et taille.
- On termine par une étude systématique de l’abdomen.
- Pour la voie endo-vaginale :
- Etude de l’utérus : position, biométrie, endomètre.
- Etude des ovaires : morphologie, taille.
- Recherche d’un épanchement pelvien.
7 . 2 . 4 - Clichés, compte rendu :
L’établissement d’un compte-rendu de l’examen fera apparaître les éléments suivants :
Clinique :
- Indication,
- Circonstances : âge, jour du cycle, durée et régularité des cycles, état de ménopause. Historique : métrorragies, ménorragies, dysménorrhée, algies pelviennes, masse pelvienne à l’examen clinique, suspicion de GEU, hypofertilité, surveillance de stérilet, surveillance thérapeutique, bilan de dystrophie ovarienne, etc.
- Antécédents : césarienne, myomectomie, hystérectomie, endométrite, ovariectomie, kyste ovarien, endométriose, etc.
- Résultats d’examen antérieurs : anciennes échographies, autres examens d’imagerie médicale éventuels.
- Thérapeutique en cours : oestro-progestatifs, progestatifs, anti-oestrogènes.
Technique – voie d’abord :
- Conditions de l’examen.
Résultat :
-
Utérus :
- Position : antéversé, rétroversé, intermédiaire, antéfléchi, rétrofléchi.
- Contour : régulier ou non.
- Biométrie du corps (en mm) : surtout diamètre antéro-postérieur du corps par voie endo-vaginale.
- Myomètre : homogène ou non, diamètre et localisation d’éventuels myomes.
- Endomètre : développé ou hypotrophique, bien défini ou non, épaisseur en précisant s’il s’agit de la mesure d’une ou de deux faces, échogénicité : hypo ou hyperéchogène, échostructure : ne préciser que si elle est hétérogène.
- Cavité : ligne cavitaire bien définie ou non, régulière ou non.
- Col : échostructure homogène ou non.
- Doppler : à adapter en fonction de la pathologie existante ou suspectée : flux parenchymateux du myomètre, de l’endomètre ou des ovaires.
- Ovaires :
- Visibilité : signaler la non visibilité.
- Biométrie : du grand axe souvent suffisant, sinon des deux plus grands diamètres perpendiculaires.
- Volume.
- Structure.
- Follicules : si nécessaire on précisera leur nombre et le diamètre du follicule dominant.
- Cul de sac de Douglas : libre ou épanchement.
7 . 2 . 5 - Conclusion :
Aspect de l’endomètre et des ovaires concordant ou non avec la période du cycle, l’état de ménopause ou la thérapeutique.
Absence d’anomalie pelvienne échographiquement décelable.
Citation des anomalies éventuelles avec hypothèses étiologiques. Organes non vus ou à contrôler.
7 . 2 . 6 - Iconographie :
Coupe sagittale muco-cavitaire de l’utérus avec repères biométriques.
Coupe de chaque ovaire selon son plus grand axe.
Clichés argumentant une éventuelle pathologie.
7 . 3 - Echo-anatomie normale en gynécologie
7 . 3 . 1 - L’utérus
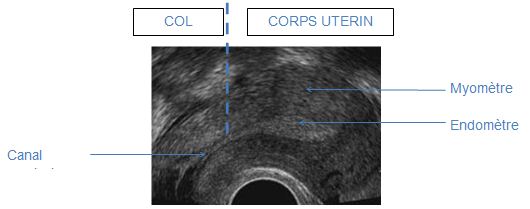
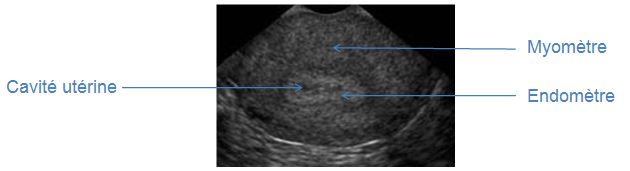
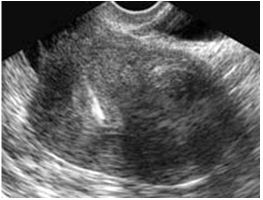
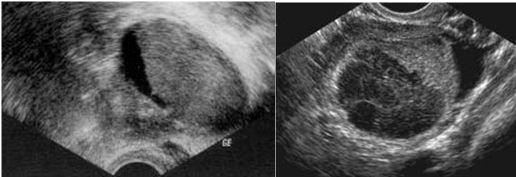
Figure 3 : Coupe sagittale médiane de l’utérus en échographie endovaginale
La coupe sagittale de l’utérus permet d’en mesurer sa longueur et son épaisseur. La longueur de l’utérus doit toujours être prise avec le col. La taille de l’utérus varie selon l’âge et la parité de la patiente, mais les variations de mesure de l’utérus sont faibles lors du cycle ovarien.
7 . 3 . 1 . 1 - Le myomètre :
Le myomètre apparaît sous la forme d’une structure solide, peu échogène et homogène. Sa transsonicité augmente légèrement en fin de cycle (hypervascularisation, œdèmes). Ses contours externes sont bien délimités, présentant parfois des zones anéchogènes donnant un signal Doppler de type veineux.
7 . 3 . 1 . 2 - L’endomètre
L’endomètre apparaît comme une image régulière, plus échogène que le myomètre, dont l’origine fine commence au niveau du col.
La mesure de l’épaisseur de l’endomètre, en coupe sagittale médiane de l’utérus, se fait perpendiculairement à la surface de l’utérus à l’endroit le plus épais de l’endomètre. Elle comprend les deux couches de l’endomètre.
Son épaisseur et son écho structure évoluent avec le cycle ovarien :
- Du 4ème au 6ème jour du cycle correspondant à la fin des menstruations, l’endomètre peut être très fin et peut être représenté par une fine ligne échogène.
- Dans la phase de prolifération, l’endomètre grossit progressivement et apparaît plus échogène. En pré ovulation, vers le 14ème jour du cycle, l’endomètre atteint une épaisseur de 10 à 12 mm.
- En phase lutéale, jusqu’au 20 ou 25ème jour du cycle, l’épaisseur de l’endomètre atteint un maximum de 10 à 15 mm, il se transforme en une bande centrale forte en échos.
- Au début des menstruations, on retrouve des zones faibles en échos correspondant à des signes de desquamation.
7 . 3 . 1 . 3 - La cavité utérine
Normalement virtuelle en dehors de la période menstruelle, elle apparaît sous la forme d’une fine ligne médiane, hyperéchogène, appelée aussi ligne de vacuité. Elle correspond à l’accolement des deux interfaces de l’endomètre.
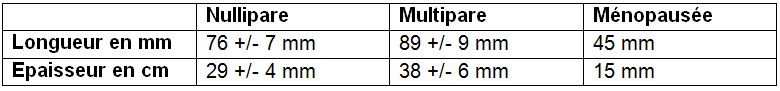
Biométrie de l’utérus :
Elle fait partie intégrante de l’examen échographique. Trois dimensions sont classiquement exploitables :
- Mesure du diamètre antéro-postérieur : la plus utilisée car la plus fiable, elle s’effectue sur une coupe longitudinale à l’endroit le plus épais du corps utérin, perpendiculairement à l’axe de la cavité utérine. De 20 à 40 mm chez la nullipare, il passe de 24 à 45 mm chez la multipare.
- Diamètre transversal : présente peu d’intérêt car trop imprécis.
- Longueur totale de l’utérus : très imprécise du fait de la difficulté à positionner correctement les calipers.
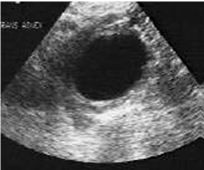
7 . 3 . 2 - Les ovaires
7 . 3 . 2 . 1 - Localisation :
Les ovaires apparaissent comme de petites formes ovoïdes à grand axe oblique, d’échogénicité variable, à contours nets. Leur repérage est facilité par l’existence en leur sein de formations liquidiennes correspondant aux follicules.
Ils peuvent se situer n’importe où dans le pelvis, rarement symétriques sur les coupes transversales, on les recherchera au niveau du cul de sac de Douglas, de part et d’autre et en arrière de la partie inférieure de l’utérus, contre l’utérus ou plus latéralement dans l’excavation. Dans les conditions normales, ils ne sont jamais situés en avant de l’utérus.
7 . 3 . 2 . 2 - Echostructure :
Elle est variable en fonction de l’âge de la patiente et de la période du cycle.
Variations dues à l’âge :
- En période prépubertaire, les ovaires mesurent rarement plus de 30 mm et peuvent contenir des formations anéchogènes arrondies dont le diamètre ne dépasse jamais 15 mm.
- Ce même aspect se retrouve parfois plusieurs années après la ménopause.
7 . 3 . 2 . 3 - Dimensions :
Après repérage et sur une coupe passant par leur plus grand axe, ils ne dépassent pas 40 mm dans les conditions normales.
7 . 3 . 2 . 4 - Variations au cours du cycle :
- En phase folliculaire : en début de cycle, le nombre et la taille des follicules est variable au sein d’un ovaire ou des deux. Normalement, un seul, le follicule dominant poursuit une croissance quotidienne, au rythme de 2 à 3 mm par jour jusqu’à atteindre 20-24 mm dans les heures précédant l’ovulation.
- Ovulation : elle correspond à l’affaissement du follicule précédemment observé qui perd son caractère de collection liquidienne sous tension. On observe parfois une lame liquidienne au niveau du cul de sac de Douglas.
- En phase lutéale : apparition d’une structure centro-ovarienne, hypoéchogène correspondant au corps jaune, pouvant parfois être kystique.
7 . 3 . 3 - Les trompes
Non visibles à l’état normal, tout au plus peut-on visualiser par voie endo-vaginale la portion initiale de la trompe qui prolonge la corne utérine en dehors.
7 . 3 . 4 - Le Douglas
Le Douglas est chez la femme debout le point le plus déclive de la cavité abdominale. Ainsi, tous les liquides qui arrivent dans la cavité abdominale et qui ne sont pas encapsulés, peuvent être visualisés dans le cul de sac de Douglas.
De façon physiologique, on peut très souvent observer dans le Douglas du liquide libre, anéchogène ou faible en échos. En particulier, celui-ci peut provenir du liquide folliculaire après l’ovulation. De façon physiologique, on peut également y trouver un ou les deux ovaires. Des annexes tumorales tombent souvent, du fait de la gravité, dans le cul de sac de Douglas.
Les constations les plus usuelles dans le Douglas sont des anses intestinales grêles dont le cheminement, le calibre et le péristaltisme sont facilement définis.
7 . 3 . 5 - La vessie
Organe le plus antérieur du pelvis, sa forme est directement liée à son degré de réplétion. En réplétion, elle apparait comme une structure anéchogène, homogène, à parois minces, située en arrière et au-dessus de la symphyse pubienne. C’est la « fenêtre acoustique » de la voie abdominale. L’échographie endo-vaginale, quant à elle, se réalise vessie vide.
7 . 4 - Indications
7 . 4 . 1 - Fibromes utérins
Il faudra préciser leur nombre, leur taille, leur localisation et l’épaisseur de la paroi utérine en arrière du fibrome (mur postérieur) en vue d’un traitement hystéroscopique. Le tissu du fibrome est usuellement moins vascularisé que celui du myomètre adjacent. L’aspect est donc celui d’une masse souvent hypoéchogène, plus ou moins homogène selon sa taille avec d’éventuels remaniements : calcifications, nécrobiose ou œdème. Cette image est bien limitée, en général entourée d’un halo hypoéchogène traduisant la présence de vaisseaux encorbellés, identifiables en doppler couleur.
- Gros utérus fibreux : la forme générale de l’utérus est conservée, mais la mesure du diamètre antéro-postérieur permet aisément le diagnostic. Le plus souvent, elle ne vient que confirmer une hypothèse clinique. Il s’agit soit d’une simple hypertrophie du myomètre, soit le plus souvent de la juxtaposition de multiples petits myomes interstitiels.
- Myome interstitiel ou intra-mural : lésion délimitée par un fin liséré échogène.
- Myome sous-muqueux : son identification est nettement moins facile à réaliser que par hystérographie ou hystéroscopie. Il est souvent plus volumineux qu’un polype et hypoéchogène.
- Myome sous-séreux : très facile à décrire dans la majorité des cas, sa présence se traduit par une déformation évidente des contours. En cas de myome sous-séreux pédiculé, si le pédicule est long et étroit, la masse échogène du myome peut être confondue avec une formation annexielle.
7 . 4 . 2 - Malformations utérovaginales
La description échographique des anomalies utérines se fait plus facilement en deuxième partie de cycle. L’utérus doit être analysé en coupe sagittale de droite à gauche et en coupes axiales. En coupe sagittale, on se concentre sur l’épaisseur du myomètre au niveau fundique et sur la forme de la cavité endométriale.
- L’échographie peut affirmer le diagnostic de syndrome de Rokitansky devant une aplasie vaginale par la mise en évidence d’un noyau utérin rétro-vésical. En cas d’aplasie vaginale avec utérus fonctionnel, l’échographie apprécie le volume utérin et précise l’état de l’endomètre.
- En cas d’aplasie utérine unilatérale, l’échographie permet d’affirmer le type unicorne ou pseudo-unicorne par la mise en évidence, en coupe transversale, d’un noyau utérin et d’une annexe.
- En cas de bifidité utérine, l’échographie précisera le diagnostic d’utérus bicorne ou cloisonné. Sur les coupes transversales, les deux hémicavités sont bien visibles, leur axe est divergent et il existe assez souvent un enfoncement en coin postérieur de la vessie.
L’échographie est donc une exploration intéressante dans le bilan d’une malformation utérovaginale mais présente cependant des limites. La coelioscopie reste indispensable pour confirmer le type précis de la malformation, préciser les lésions associées et proposer une thérapeutique.
7 . 4 . 3 - Pathologie de l’endomètre
- Endomètre atrophique : qu’il soit d’origine iatrogène ou hypertrophique, l’échographie visualisera une fine lame hyperéchogène médiane, de 1 à 3 mm d’épaisseur.
- Endomètre hypertrophique : en rapport avec une hyperestrogénie parfois iatrogène, il peut présenter plusieurs aspects échographies qui doivent toujours être rapportés à la période du cycle étudié et à l’âge de la patiente. Il peut s’agir d’une hypertrophie simple où l’endomètre est épais, homogène, d’échogénicité supérieure à celle du myomètre, d’une hypertrophie avec atteinte polypoïde de l’endomètre s’accompagnant de petites formations nodulaires hypoéchogènes ou d’une hypertrophie à caractère kystique où l’on retrouve au sein de l’endomètre de petites formations liquidiennes.
- Polypes de l’endomètre : sur le plan échographique, ils se présentent classiquement sous la forme d’une structure arrondie, voire oblongue, hypoéchogène, intracavitaire. Des remaniements structuraux peuvent expliquer au contraire l’apparition d’une hyperéchogénicité. Le diagnostice de certitude est l’apanage de l’hystéroscopie.
- Cancer de l’endomètre : le diagnostic de carcinome de l’endomètre ne se fait pas à l’échographie mais en histologie. Toutefois on peut suspecter une tumeur endométriale sur la présence d’un endomètre très épaissi et d’une délimitation endomètre-myomètre irrégulière. En effet le plus souvent l’endomètre présente les mêmes caractéristiques que l’hypertrophie simple. Parfois on retrouvera des signes plus évocateurs : disparition de la ligne de vacuité, contours irréguliers sans clivage visible avec le myomètre. L’existence d’une zone de faible échogénicité sous-endométriale serait un bon reflet de l’absence d’invasion du myomètre. L’exploration vélocimétrique avec codage couleur représente une aide au diagnostic différentiel entre hyperplasie simple et dégénérescence carcinomateuse. En effet au niveau des zones de dégénérescence de l’endomètre, on relève l’apparition d’une néovascularisation où les index de résistance ou de pulsatilité sont significativement modifiés (flux diastolique élevé).
7 . 4 . 4 - Surveillance des stérilets
Les trois caractères fondamentaux topographiques du stérilet normalement inséré dans la cavité utérine – intracavitaire, central, haut situé – s’apprécient sur les coupes sagittale, transversale (et éventuellement frontale par voie abominale). Le DIU est facilement identifiable, fortement échogène, il se détache franchement des tissus avoisinants.
- En coupe longitudinale, la branche verticale apparait sous la forme d’un trait rigide, hyperéchogène, flanqué de son ombre portée. Son extrémité supérieure doit se situer au contact du fond utérin et son extrémité inférieure doit rester à distance de l’isthme.
- En coupe transversale, la tige verticale est bien visible sous la forme d’une zone punctiforme hyperéchogène située au centre de la cavité endométriale et la tige horizontale en remontant la sonde en direction du fond utérin.
Les migrations du stérilet, si elles sont souvent suspectées cliniquement (disparition des fils, fils trop longs), pourront être affirmées grâce à l’échographie : migration vers le bas ou intramurale, malposition cavitaire ou plus rarement migration intrapéritonéale (absence de stérilet intracavitaire, présence d’un stérilet sur un cliché radiologique du pelvis).
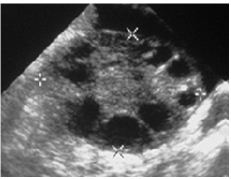
7 . 4 . 5 - Pathologie fonctionnelle de l’ovaire
Plusieurs types d’images peuvent être identifiés :
- Image anéchogène isolée de l’ovaire : sa disparition dans le temps au décours des règles ou après blocage ovulatoire signe le caractère fonctionnel de ce kyste caractérisé par la netteté de ses contours, bien arrondis.
- Image anéchogène avec cloisons unique ou multiples sous forme d’interfaces finement échogènes. La finesse des cloisons, leur caractère dépressible plaident a priori pour le caractère fonctionnel de l’image.
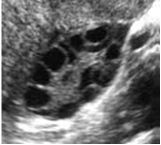
- Images anéchogènes de petite taille, qui se répartissent en périphérie sous la corticale ovarienne autour d’un stroma hyperéchogène. Un tel aspect s’observe dans le cadre de la dystrophie micropolykystique. Le volume de l’ovaire est alors volontiers augmenté.
- Image échogène, à répartition plus ou moins homogène des échos plaide en faveur d’un phénomène hémorragique.
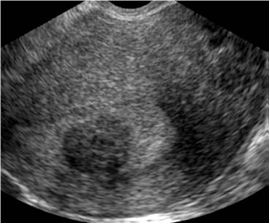
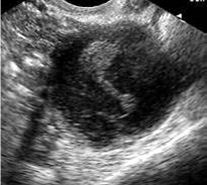
7 . 4 . 6 - Tumeurs de l’ovaire
Le rôle de l’échographie dans le diagnostic reste primordial mais toujours en confrontation avec d’autres techniques : scanner ou IRM, cœlioscopie et confirmation anatomopathologique. La connaissance de la séméiologie échographique est indispensable pour interpréter des images dans les contextes cliniques les plus divers. C’est l’un des inconvénients majeurs de l’échographie ovarienne : à une même image, correspondent des situations radicalement différentes.
- Kyste séreux : formation anéchogène à contours nets. L’échographie apporte une information de mesure très précise, permettant d’en suivre l’évolution à deux examens successifs. Le critère d’organicité ne peut pas toujours être apporté, même si un diamètre supérieur à 5 cm plaide en faveur d’une telle origine.
- Kyste mucineux : la structure interne du kyste est remplie de fins échos réguliers. Ils peuvent également présenter des septas et être de grande taille
- Kyste endométriosique : plus échogène du fait des caractéristiques physiques du liquide contenu (« chocolat »). Des critères anatomiques supplémentaires doivent être recherchés : fixité, solidarisation avec les organes voisins, péritoine et surtout utérus, siège préférentiellement rétro-utérin.
- Kyste dermoïde : structure mixte alternant des plages liquidiennes échogènes (liquide huileux) et très échogènes générant des cônes d’ombre nets (tissus osseux, cartilagineux), amas moyennement denses correspondant à des regroupements d’éléments pileux.
-
Le carcinome ovarien : l’aspect échographique des tumeurs ovariennes est très hétérogène, dans 13% des cas il s’agit d’images kystiques, dans 68% des cas, d’images mixtes solido-kystiques, et dans 19% de lésions uniquement solides. Les critères de suspicion d’une néoplasie ovarienne sont :
- une tumeur solido-kystique, irrégulière, traversée par des septas épais (> 3 mm), présentant des végétations papillaires : pour cela, utiliser des sondes à haute fréquence pour déceler de petites irrégularités au niveau du contour interne ;
- ou en présence d’une tumeur solide à contours irréguliers ;
- la présence d’ascite ou de métastases hépatiques ;
- l’apparition d’une néovascularisation en vélocimétrie Doppler avec codage couleur et une diminution des résistances vasculaires : les tumeurs malignes apparaissent le plus souvent hypervasculariésées. Inversement, l’absence de flux possède une excellente valeur diagnostique en faveur de la bénignité.
On ne perdra cependant pas de vue que ces images correspondent à des tumeurs à des stades avancés, où déjà des phénomènes d’expansion rapide de la tumeur et de nécrose sont venues remanier celle-ci. C’est pourquoi le rôle de l’échographie est d’orienter le plus rapidement possible vers une origine organique nécessitant une exploration chirurgicale.
7 . 4 . 7 - Torsion de kyste
Elle est associée à un contexte clinique évocateur avec douleur aiguë liée à l’ischémie de l’annexe, souvent précédée d’épisodes de subtorsion. Les signes échographiques sont les suivants :
- Augmentation du volume de l’ovaire,
- Contenu hétérogène ou hématique,
- Œdème périphérique,
- Kyste souvent ascensionné, douloureux spontanément ou au passage de la sonde,
- Au doppler couleur, absence de flux en cas de torsion complète et augmentation des résistances,
- Epanchement souvent associé.
7 . 4 . 8 - Trompes
Infections pelviennes :
En dehors d’un contexte anamnestique, clinique ou biologique évocateur, la séméiologie échographique n’a le plus souvent aucune spécificité propre. Devant un tableau évocateur, elle permettra cependant une approche diagnostique et contribuera au suivi évolutif à la suite d’un traitement.
En fonction du stade évolutif, la séméiologie varie :
- l’absence de toute traduction échographique de signes cliniques et biologiques évocateurs d’atteinte aiguë tubaire ne doit pas faire exclure le diagnostic. On notera parfois un « flou » de l’imagerie du fait de phénomènes locaux d’œdèmes et d’inflammation.
- Le pyosalpinx se présente sous la forme d’une masse para-utérine uni ou bilatérale, à contours bien marqués, à parois épaisses, irrégulières, à contenu échogène, hétérogène (pus et débris nécrotiques).
- L’hydrosalpinx séquellaire donne une image oblongue para-utérine à cntours nets, à contenu liquidien le plus souvent anéchogène uni ou bilatérale.
- L’abcès du Douglas présente les mêmes caractères sémiologiques que le pyosalpinx.
Grossesse extra-utérine :
la grossesse extra-utérine, le plus fréquemment tubaire (96% des cas), est plus rarement intra-murale, cervicale, ovarienne ou péritonéale. L’image échographique est très variable. Par principe, il faut penser à une GEU chaque fois qu’un test urinaire ou sanguin de grossesse est positif et que l’on ne met pas en évidence de sac gestationnel intra utérin.
Une grossesse intra-utérine évolutive peut se reconnaitre par :
- La présence dès 4 SA ½ d’un sac gestationnel intra-utérin,
- La présence d’une vésicule vitelline dès 5 SA,
- L’identification d’une activité cardiaque dès 5 SA ½.
Le seul signe direct d’une GEU est l’identification d’une activité cardiaque extra-utérine, mais cette situation est malheureusement très peu fréquente. Le plus souvent, ce sont des signes indirects qui font penser à la GEU :
- Présence d’un endomètre épais, échogène, homogène (décidualisation),
- Présence d’un épanchement au niveau du cul de sac de Douglas,
- Présence d’une masse annexielle hétérogène.
La fiabilité du couple échographie – βHCG plasmatique pour le diagnostic de la GEU avoisine les 98% (EMC). On admet aujourd’hui qu’un sac gestationnel peut être visualisé en situation intra-utérine lorsque son diamètre atteint 3 mm et lorsque le taux plasmatique de βHCG est supérieur ou égal à 800 à 1000 UI/ml. En cas de doute et en l’absence de symptomatologie, un nouveau dosage 48h plus tard permettra d’y voir plus clair.
7 . 4 . 9 - Echographie interventionnelle
Voies d’abord : elles peuvent être toutes utilisées qu’elles soient abdominale, vaginale ou transvésicale, selon les possibilités techniques et la plus grande facilité d’atteindre la cible.
Indications :
- Prélèvements ovocytaires dans le cadre de la fécondation in vitro : la ponction de follicules se réalise le plus souvent par voie vaginale sous contrôle échographique endovaginal. En règle générale, une anesthésie locale est suffisante.
- Ponctions de kystes de l’ovaire : elle apporte des éléments diagnostiques complémentaires et permet d’éviter des interventions pour kyste fonctionnel.
- Ponctions évacuatrices de masses pelviennes : il peut s’agir de collections infectieuses purulentes ou d’hématomes secondaires à une chirurgie pelvienne.
7 . 4 . 10 - Monitorage échographique de l’ovulation
Aujourd’hui utilisé en routine pour surveiller les inductions de l’ovulation des femmes anovulantes, les stimulations en vue d’insémination, et les superovulations en vue de FIV, le monitorage ovarien associe l’échographie par voie vaginale et les dosages d’œstradiol (E2). Les buts principaux du monitorage ovarien sont :
- Avant la mise en route du traitement inducteur, une échographie de référence permet d’apprécier l’état basal de l’ovaire : nombre de microkystes latents, degré de vascularisation ovarienne.
- Détecter le début de la réponse folliculaire et donc l’efficacité de la dose d’induction utilisée.
- Evaluer la qualité de la réponse : elle s’apprécie par son caractère pauci ou plurifolliculaire et par la dynamique de la croissance folliculaire (croissance rapide de 2,5 mm/j et soutenue dès J5 à J7), de l’E2 et de l’endomètre.
- Déterminer le moment optimal pour déclencher l’ovulation et/ou faire l’insémination ou le prélèvement ovocytaire. Le Doppler couleur peut également être utilisé pour objectiver une « illumination vasculaire » du follicule dominant après le début du pic de LH.
- Diminuer le risque de complications : risque de grossesses multiples ou d’hyperstimulation.
- Vérifier la réalité de la rupture folliculaire.
- L’étude de la vascularisation utérine joue également un rôle important lors de la réimplantation, en appréciant la réceptivité endométriale, et améliore ainsi les chances de grossesse.
7/13