- Pré-requis et Objectifs
- Cours
- Annexes
- Votre Avis
- Ressources Enseignants
Introduction
L’hémochromatose génétique (HG) est une maladie autosomale récessive responsable d’une hyperabsorption digestive de fer avec pour conséquence une accumulation progressive de fer dans l’organisme. Elle touche en particulier le foie (cirrhose et cancer), le pancréas (diabète) et le cœur (cardiomyopathie). Sa prévalence en France est de l’ordre de 5 pour mille.
L’HG est due à une mutation du gène HFE de type C282Y. À l’état homozygote, cette mutation donne l’HG. Il existe d’autres causes de surcharge ferrique non associées à une homozygotie C282Y.
1 - Physiologie de l'absorption du fer
Le fer est présent dans l’organisme sous deux formes : fer ferreux et fer ferrique. Du fait de sa toxicité et de la formation possible de dérivés réactifs de l’oxygène, il n’existe pas à l’état libre mais sous forme de complexes. L’organisme possède 3 à 4 g de fer. La majorité du fer fonctionnel est sous forme héminique dans l’hémoglobine (2,5 g), la myoglobine, les cytochromes et certaines enzymes. Le fer non héminique est lié à la transferrine (ou sidérophiline) pour son transport et il est stocké sous forme de ferritine et d’hémosidérine (0 à 1 g).
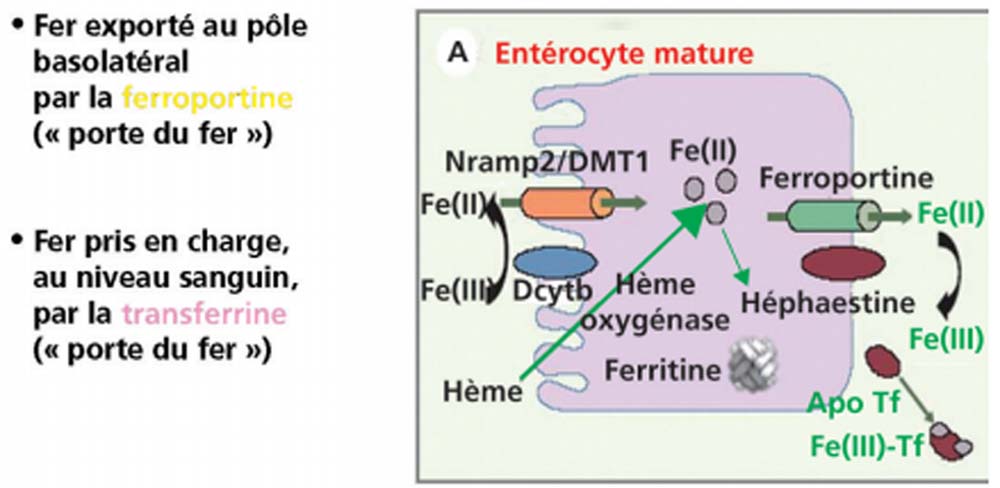
Le fer est absorbé par voie digestive au niveau du duodénum (fig. 22.1). 5 à 10 % seulement du fer alimentaire est absorbé, soit environ 1 mg/jour, ce qui compense les pertes quotidiennes. Le fer est absorbé par l’entérocyte soit sous forme de sel, soit directement sous forme d’hème. Le fer est d’abord réduit sous forme ferreuse au pôle apical des entérocytes, puis transporté à travers la membrane plasmique. L’hème est transporté par un autre mécanisme impliquant un récepteur spécifique. Le fer est libéré dans la cellule par l’hème oxygénase.
Il peut :
– être utilisé par la cellule ;
– être stocké sous forme de ferritine ;
– surtout être pris en charge par un autre transporteur, la ferroportine au pôle baso-latéral de l’entérocyte où il est réoxydé en fer ferrique par une ferroxydase appelée hephaestine. Il est ensuite pris en charge par la transferrine au niveau du plasma.
Fig. 22.1. Acquisition du fer par l’entérocyte et passage dans le sang
1 . 1 - Transport sanguin et captation par les cellules périphériques
Une molécule de transferrine est capable de lier deux ions ferriques. La capacité totale de fixation du fer par la transferrine correspond à environ 3 fois la quantité de fer circulant, ce qui correspond à une saturation de la transferrine de 33 %.
Un litre de sang contient environ 500 mg de fer.
La réserve de fer dans l’organisme est comprise entre 0 et 1 g de fer, essentiellement dans le foie, la moelle osseuse et la rate. Le fer étant toxique du fait de sa capacité à former des dérivés actifs de l’oxygène, il est stocké sous forme de ferritine et de façon plus accessoire, sous forme d’hémosidérine, forme dégradée de ferritine dans les lysosomes.
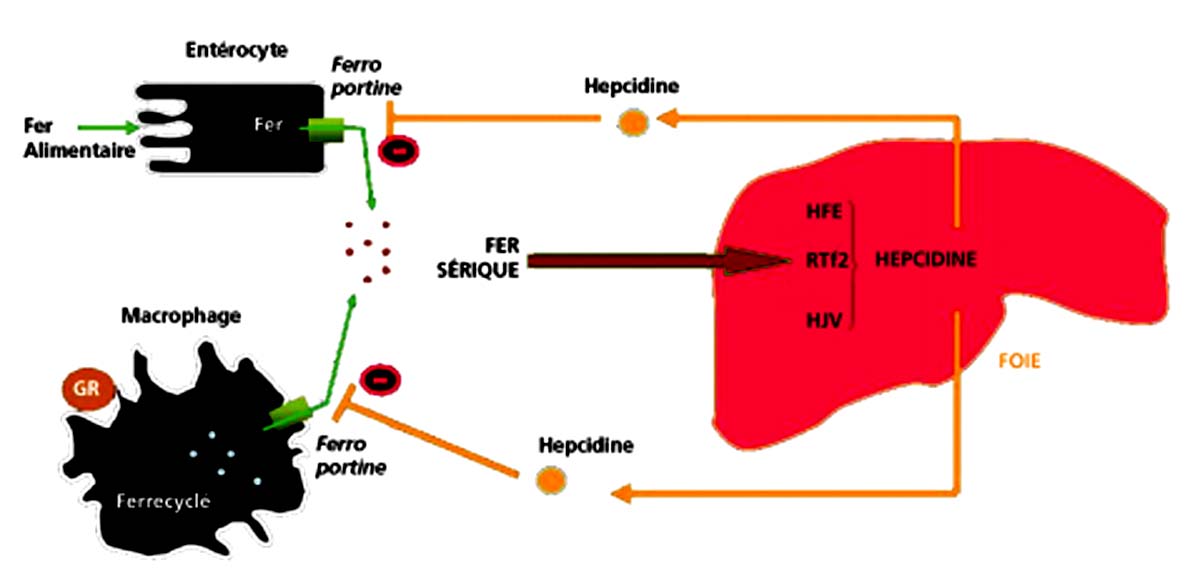
1 . 2 - Régulation de l’absorption intestinale du fer (fig. 22.2)
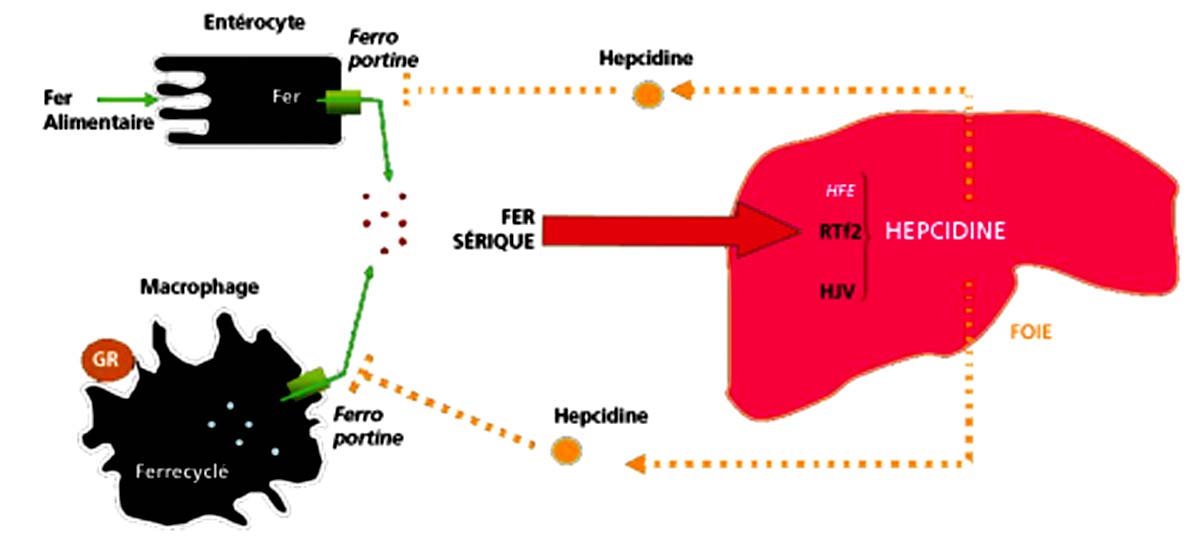
Les entérocytes reçoivent des signaux humoraux déterminés par l’état des réserves en fer de l’organisme. C’est l’hepcidine qui joue ce rôle. La sécrétion d’hepcidine est en rapport avec une interaction dans le foie entre 3 protéines : la protéine HFE, le récepteur de la transferrine RTf 2, et l’hémojuvéline. La sécrétion d’hepcidine n’est plus assurée en cas de mutation homozygote C282Y. En son absence, l’absorption du fer de même que la sortie du fer des macrophages ne sont plus régulées (fig. 22.3).
1/7