2
-
Conséquences périnatales des drogues illicites
2
.
1
-
Opiacés
Drogues sédatives = héroïne par injection intraveineuse, sniffée ou fumée ; codéine ; antalgiques morphiniques détournés per os ou IV (sulfate de morphine, tramadol,…) ; traitements de substitution aux opiacés prescrits ou détournés : méthadone ou buprénorphine haut dosage.
Ils ne sont pas tératogènes.
La consommation d’héroïne aboutit souvent à une découverte tardive de la grossesse, du fait de l’aménorrhée très fréquente, et à un mauvais suivi obstétrical, facteur de RCIU et de prématurité.
Le risque fœtal majeur est une hypoxie aiguë, pouvant aboutir à une mort in utero, secondaire non pas aux épisodes de shoot (sauf en cas d’overdose) mais aux épisodes de manque :
- un syndrome de manque chez une femme enceinte dépendante des opiacés est une situation à haut risque fœtal et une indication urgente de mise en route d’un traitement de substitution aux opiacés ;
- un sevrage est possible en cours de grossesse mais comporte trop de risques de rechute et de déstabilisation pendant le post-partum.
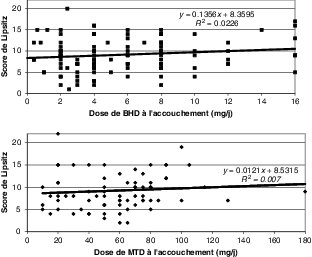
Le traitement de substitution aux opiacés par méthadone ou buprénorphine haut dosage a beaucoup amélioré le pronostic : prévention des épisodes d’hypoxie fœtale grâce à un taux d’opiacés plus stable, amélioration du suivi de grossesse, diminution des co-consommations si la posologie est suffisante et amélioration du lien mère/enfant. En revanche, le risque de syndrome de sevrage néonatal est pratiquement le même que sous héroïne, sans aucune corrélation entre la posologie du traitement de substitution et l’intensité du syndrome de sevrage néonatal (figure 27.1).
Il est donc inutile et dangereux de diminuer la posologie du traitement de substitution en fin de grossesse dans l’espoir fallacieux de diminuer le risque de syndrome de sevrage néonatal ; le vrai risque serait de favoriser la reprise d’autres drogues.
Il est même souvent nécessaire d’augmenter la posologie au 3e trimestre à cause de modifications pharmacodynamiques (augmentation de l’espace de diffusion et diminution de la demi-vie). La méthadone et la buprénorphine haut dosage ont les mêmes efficacités et tolérances dans ce contexte.
La pathologie néonatale la plus redoutée par les soignants et les parents est la survenue d’un syndrome de sevrage néonatal. Il survient chez 40 à 60 % des nouveau-nés de mères ayant consommé pendant la grossesse des opiacés. Il apparaît le plus souvent au cours des 24 à 36 premières heures de vie pour l’héroïne et la buprénorphine alors qu’il est un peu plus tardif pour la méthadone, entre le 2e et le 7e jour de vie. La symptomatologie clinique du syndrome de sevrage peut comporter :
- une irritabilité du système nerveux central : agitation intense, trémulations, hyperréactivité, clonies ou plus rarement convulsions, cris aigus continus et troubles du sommeil, lésions cutanées de frottement ;
- des troubles digestifs : mauvaise succion, vomissements, diarrhée, pouvant être responsables d’une déshydratation et/ou d’une mauvaise prise de poids ;
- des troubles respiratoires et des troubles neuro-végétatifs : tachypnée irrégulière, rhinorrhée, éternuements, baillements.
Les modalités du traitement dépendent de la gravité du syndrome de sevrage qui est appréciée à l’aide du score clinique de Lipsitz ou de Finnegan (tableaux 27.7 et 27.8), qui doit être mesuré dès la naissance, au moins toutes les 6 heures, chez les nouveau-nés exposés in utero aux opiacés.
(D’après Lipsitz PJ. A proposed narcotic withdrawal score for use with new born infants : a pragmatic evaluation of its efficacy. Clin Pediatr 1975 ; 14 : 592–594.)Tableau 27.8 Score de Finnegan.
(D’après Finnegan LP, Emich JP, Connaughton JF. Abstinence score in the treatment of the infants of drug dependent mothers. Pediatr Res 1973 ; 7 : 310–26.)Les opiacés n’ont pas d’effets délétères directs démontrés sur le développement cérébral de l’enfant. Les éventuels troubles du développement sont essentiellement dus à l’environnement.
2
.
2
-
Cocaïne, crack
Drogues stimulantes = poudre de cocaïne sniffée ou fumée ou injectée, crack ou free base, fumée ou injectée.
Aux États-Unis au cours des années 1980–90, des données très alarmistes ont été publiées dans un contexte d’explosion de l’usage du crack, décrivant des lésions cérébrales et des « malformations » graves. Depuis le début des années 2000, plusieurs grandes séries ont été publiées, prenant en compte les coconsommations, en particulier d’alcool, avec des résultats beaucoup moins inquiétants. Dans ces séries, avec un groupe témoin et en analyse multivariée, l’exposition in utero à la cocaïne était corrélée (avec le tabac comme principal facteur confondant) :
- à une augmentation du risque d’hématome rétroplacentaire (odds-ratio de 4,5) ;
- à une rupture pré-terme des membranes ;
- à un fausse couche spontanée précoce ;
- à un placenta praevia, de 2,3 à 4 fois plus fréquent ;
- à des complications cardio-vasculaires maternelles : infarctus du myocarde et, lors d’une intoxication aiguë, tableau clinique associant tachycardie, hypertension artérielle, protéinurie et crise convulsive pouvant mimer une éclampsie que les examens biologiques infirmeront.
Les perturbations hémodynamiques induites par la cocaïne peuvent être responsables d’une hypoxie fœtale voire d’une mort in utero.
De nombreuses études ont montré que l’exposition prénatale à la cocaïne est associée à une baisse de l’âge gestationnel, une augmentation du taux de RCIU et à une diminution des moyennes du poids, de la taille et du périmètre crânien de naissance, dose-dépendante et plus intense en cas de consommation de crack.
L’existence d’un syndrome de sevrage néonatal est controversée : environ un tiers des nouveau-nés présente un état transitoire d’hyper-vigilance, d’hyperactivité, d’hyper-succion, avec des trémulations et un cri aigu, évoquant plutôt un syndrome d’imprégnation qu’un syndrome de sevrage (elles sont d’autant plus intenses que la dernière prise est plus récente) ; ces signes sont beaucoup moins intenses qu’après exposition aux opiacés et ne nécessitent habituellement pas de traitement médicamenteux.
Les premières publications ont signalé, dans des cas cliniques et de petites séries, un probable lien entre l’exposition prénatale à la cocaïne et la survenue de « malformations » : anomalies cérébrales, génito-urinaires, digestives (atrésies) et des extrémités (amputations de membres) ; il ne semble pas qu’il s’agissait de vraies anomalies de l’organogenèse mais de lésions ischémiques par vaso-constriction (dysruptions vasculaires). Ces faits semblent réels mais rares, plusieurs grandes séries n’ayant pas retrouvé d’augmentation significative des taux de malformations après exposition prénatale à la cocaïne par rapport aux groupes témoins.Les premières publications avaient aussi signalé un risque accru de lésions cérébrales ischémo-hémorragiques. Là encore, ces faits sont réels mais semblent rares, de grandes cohortes n’ayant pas montré d’augmentation significative. Les moins rares semblent être les hémorragies et kystes sous-épendymaires et les infarctus cérébraux.
Une méta-analyse publiée en 1997 a montré qu’il n’y avait pas de corrélation significative entre le risque de mort subite du nourrisson et l’exposition in utero à la cocaïne seule.
Le devenir à long terme des enfants exposés in utero à la cocaïne a donné lieu à de vives polémiques. Des risques majeurs ont initialement été mis en avant (« Crack Kid broken »). Ces risques ont ensuite été niés, des études montrant que comparés à des groupes témoins appariés et en prenant en compte de nombreux facteurs confondants, les tests de développement réalisés par des opérateurs ne connaissant pas les antécédents des enfants n’ont pas retrouvé de différences significatives. En 2010, une revue générale de 32 articles étudiant les effets sur le développement des enfants après 6 ans, a montré que l’exposition in utero à la cocaïne est associée à des troubles modérés des performances scolaires, atténués par la prise en compte de l’environnement.
2
.
3
-
Cannabis
Drogue perturbatrice = résine fumée le plus souvent mélangée au tabac, ce qui permet difficilement de distinguer leurs effets propres, ou plus rarement feuilles fumées.
Les effets périnatals du cannabis sont dose-dépendants et proches de ceux du tabac. Ils sont surtout dus, d’une part, au passage transplacentaire facile du principal principe actif (Δ9 tétrahydrocannabinol ou THC) et, d’autre part, à la production d’HbCO chez la mère et le fœtus. A été décrite une augmentation du risque de fausse couche spontanée, de placenta praevia, de prématurité et de RCIU.
Le cannabis ne semble pas être tératogène.
Les conséquences à court et long termes pour l’enfant sont difficiles à cerner à cause des nombreux facteurs confondants : coconsommations, surtout de tabac et d’alcool, et du style de vie de l’entourage : hyperexcitabilité et troubles du sommeil chez le nourrisson et, à long terme, hyperactivité/troubles de l’attention.
2
.
4
-
Médicaments psychotropes et surtout benzodiazépines
2
.
4
.
1
-
Drogues perturbatrices
Ce sont les seules substances psychoactives qui sont plus utilisées par les femmes que par les hommes. Il s’agit souvent de produits de rue. Elles sont souvent consommées à de très fortes doses, désinhibantes, associées à plusieurs autres substances psychoactives et dans un contexte de grande précarité. Associées aux opiacés, elles aggravent et prolongent le syndrome de sevrage néonatal. Un sevrage peut être proposé en hospitalisation en cours de grossesse.
2
.
5
-
Amphétamines
2
.
5
.
1
-
Drogues perturbatrices
Les amphétamines « festives » (ecstasy) sont le plus souvent arrêtées dès que la grossesse est connue.
En revanche, la consommation de méthamphétamine (« ice », « crystal ») injectée ou fumée se répand largement dans le monde sans avoir pour l’instant atteint notablement la France ; le contexte d’usage (grande marginalité) et les complications périnatales sont très proches de ceux du crack.
2
.
6
-
Autres drogues illicites
Les très nombreuses autres drogues utilisées par les toxicomanes sont rarement évoquées dans la littérature périnatale sauf, dans des publications très anciennes, le LSD (malformations et cassures chromosomiques) et les solvants inhalés (fœtopathie sévère proche du syndrome d’alcoolisation fœtale avec de graves lésions cérébrales.
2/6