- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Pour comprendre
- 2 - Prise en charge diagnostique devant une tumeur du sein
- 3 - Prise en charge d’une tumeur bénigne
-
4 - Prise en charge d’un cancer du sein
- 4.1 - Examen clinique
- 4.2 - Examens paracliniques
- 5 - Bibliographie
- Points essentiels
- Version Enseignants
-
Version PDF

-
Contenu
- Evaluations
- Annexes
- Votre Avis
- Ressources Enseignants
4 - Prise en charge d’un cancer du sein
Le cancer du sein est un cancer hormono-dépendant.
4 . 1 - Examen clinique
4 . 1 . 1 - Contexte de découverte
- Autopalpation ou examen par le médecin :
apparition d’un nodule du sein chez une femme ménopausée = cancer du sein jusqu’à preuve du contraire.
- Symptômes :
- Examen de dépistage.
4 . 1 . 2 - Facteurs de risque de cancer du sein +++ (tableau 20.4)
(Voir aussi chapitre 17 « Facteurs de risque, prévention et dépistage des cancers ». le cancer du sein est une maladie d’origine multifactorielle. Il existe des facteurs de risque externes, liés à l’environnement et aux modes et conditions de vie, et internes, d’origine constitutionnelle.
Tableau 20.4-Facteurs de risque de cancer du sein +++
| Facteurs de risque principaux | Autres facteurs de risque |
| Âge Antécédents personnels de cancer du sein Antécédents familiaux de cancer du sein Mastopathie à risque histologique Prédisposition génétique au cancer du sein | Exposition aux hormones Consommation de tabac Consommation d’alcool Irradiation Surpoids |
Tableau 20.4-Facteurs de risque de cancer du sein +++
4 . 1 . 3 - Examen clinique recherchant des signes suspects de malignité
- Au niveau du sein : masse dure, mal limitée, rétraction cutanée (tumeurs des quadrants inférieurs) ou de la PAM, écoulement mamelonnaire, et, dans les formes localement évoluées : adhérence à la peau et/ou au plan profond, signes inflammatoires (placard érythémateux, œdème cutané donnant un aspect de peau d’orange). La taille tumorale reste un des principaux facteurs pronostiques.
- Recherche d’adénopathies axillaires ± sus-claviculaires et de métastases à distance.
- Enfin, n’oublions pas que les cancers du sein et de l’endomètre surviennent volontiers sur les mêmes terrains, c’est dire que l’examen gynécologique doit être réalisé systématiquement chez ces patientes.
4 . 2 - Examens paracliniques
4 . 2 . 1 - Bilan sénologique (mammographie/échographie) : image suspecte classée ACR 4 ou 5
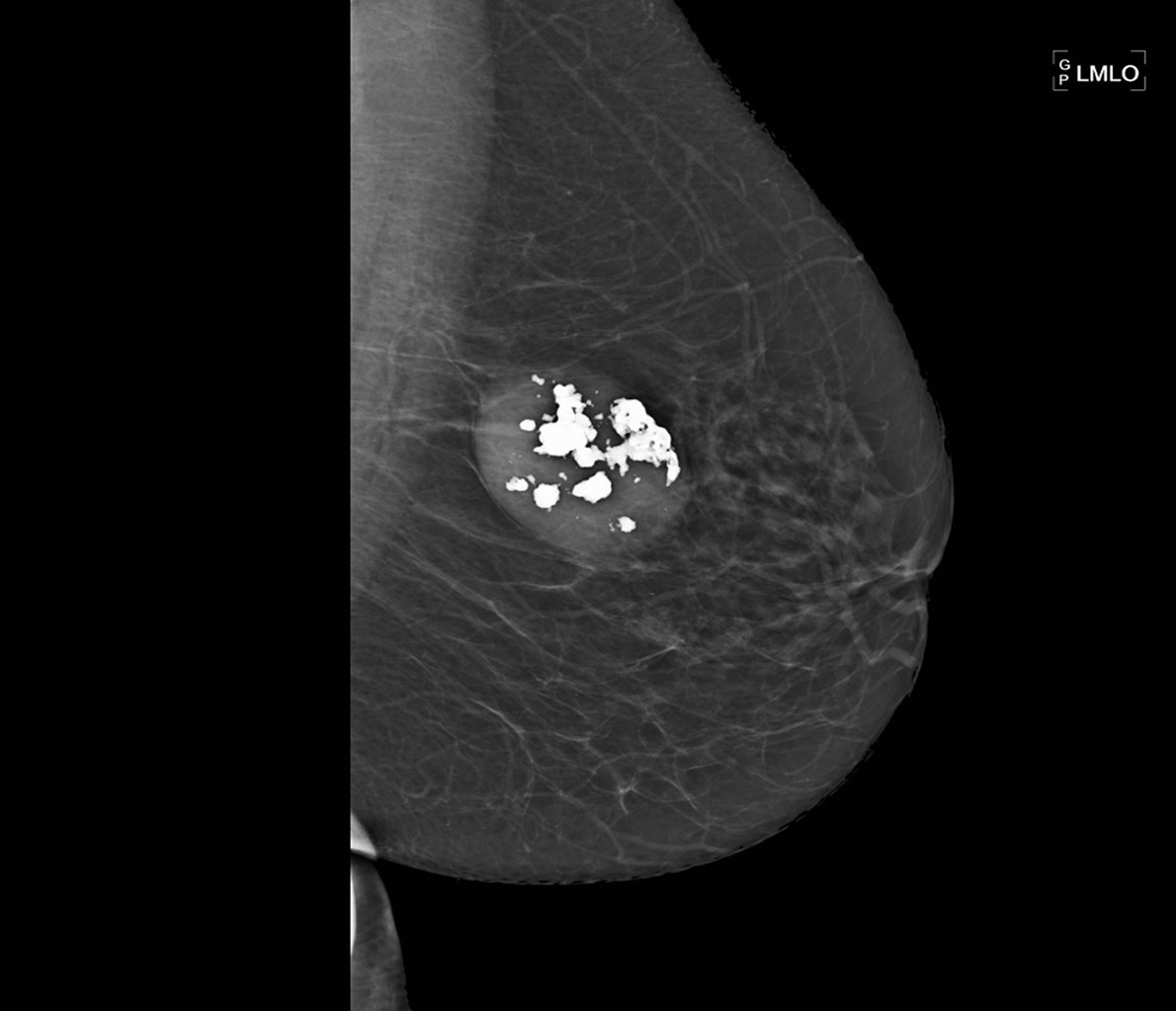
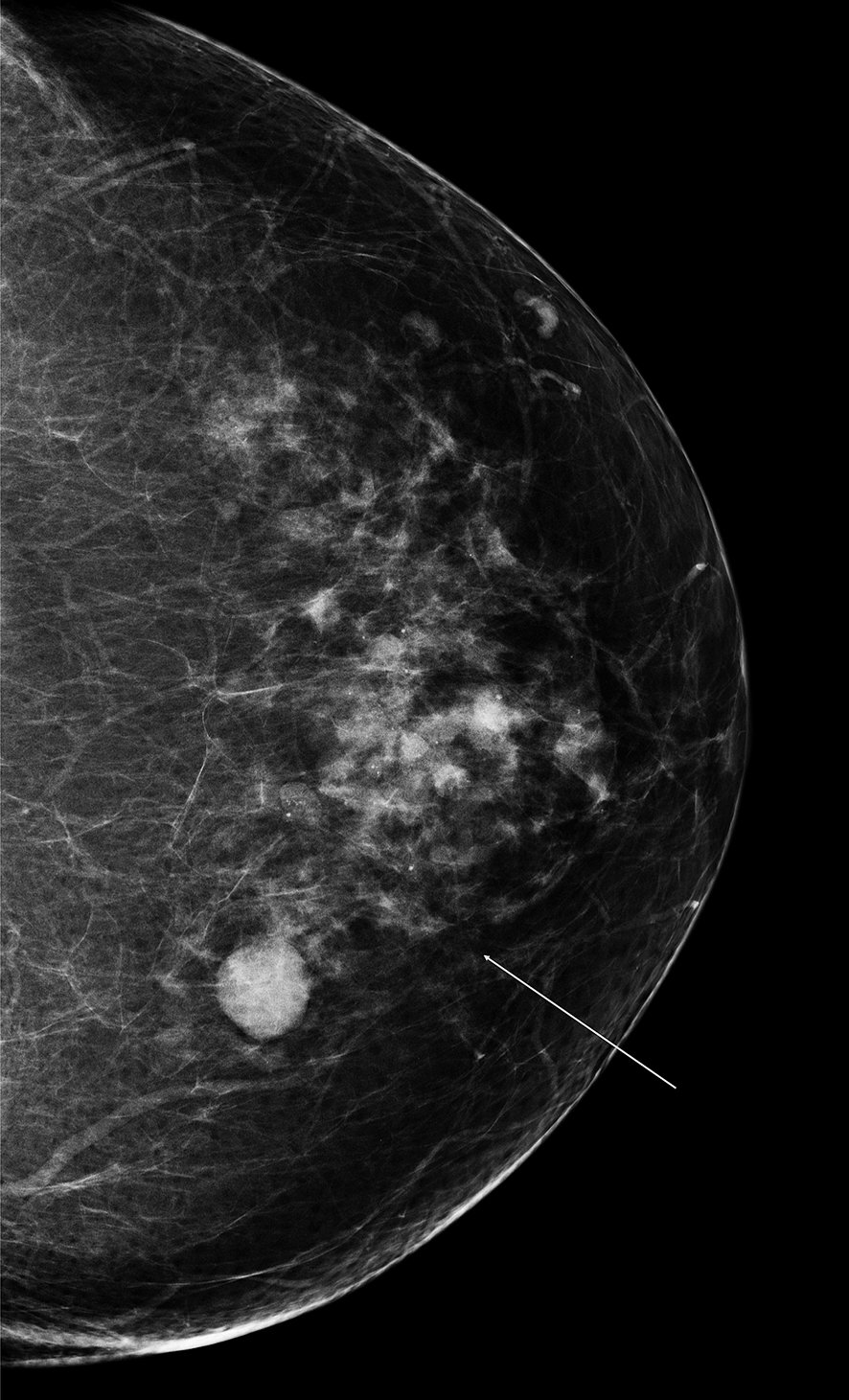
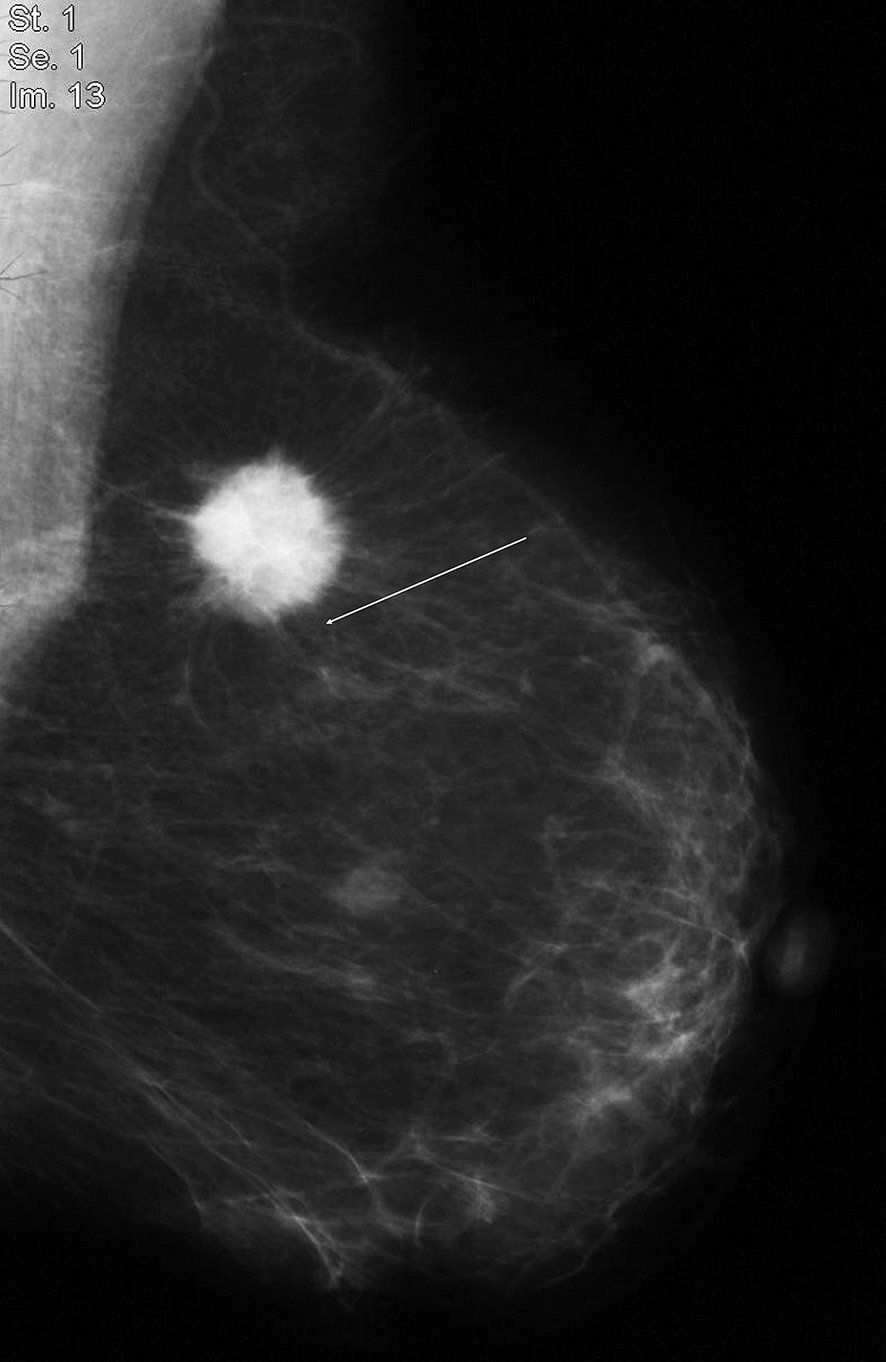
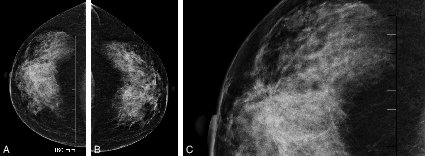
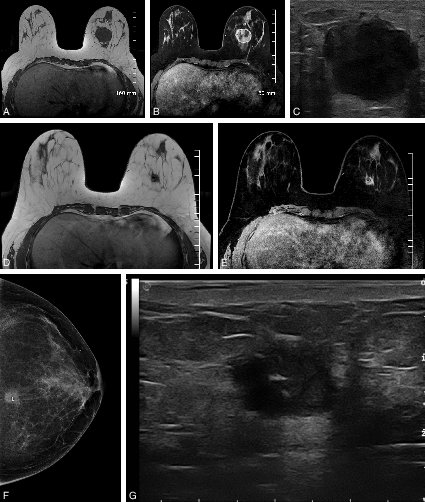
À la mammographie : masse dense spiculée (figure 20.7), rupture architecturale (figure 20.8), microcalcifications regroupées et semblant suivre un galactophore (figure 20.3).
L’échographie du creux axillaire, en cas d’adénopathies axillaires suspectes cliniquement, retrouve des ganglions axillaires augmentés de taille.
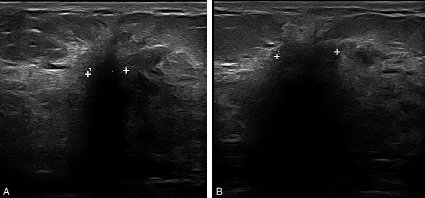
À l’échographie mammaire : nodule hypoéchogène, irrégulier, de grand axe perpendiculaire à la peau pouvant être associé à un cône d’ombre postérieur (figure 20.9).
Figure 20.5 Aspect mammographique d’un fibroadénome : image à contours réguliers avec présence de macrocalcifications.
Figure 20.6 Aspect mammographique d’un kyste (opacité arrondie, à contours nets)
Figure 20.7 Masse dense à contours irréguliers, avec spicules courts partant du bord de la masse.
Figure 20.8. A, B, C Aspect de rupture architecturale à la mammographie
Figure 20.9. A, B Image échographique suspecte d’un cancer du sein (contours flous, irréguliers, grand axe perpendiculaire à la peau, cône d’ombre postérieur)
4 . 2 . 2 - Prélèvements percutanés
Ils permettent de :
- confirmer le diagnostic histologique :
- de donner des facteurs pronostiques :
Pour information
En regroupant plusieurs de ces facteurs, on distingue actuellement 4 grands groupes de tumeurs (classification moléculaire) :
– tumeurs luminales A (RE et/ou RP positifs, HER2 négatif) ;
– tumeurs luminales B (RE ou RP positifs, HER2 positif) ;
– tumeurs triples négatives (RE, RP et HER2 négatifs) ;
– tumeurs Her2 positives (RE et RP négatifs, HER2 positifs).
4 . 2 . 3 - Prise en charge des carcinomes intracanalaires (figure 20.10)
4 . 2 . 3 . 1 - Bilan préopératoire
- Nécessité d’un repérage radiologique préopératoire (lésions le plus souvent infracliniques).
- Pas de bilan d’extension car pas de risque métastatique.
- Pas d’indication à réaliser une IRM mammaire sauf si type histologique lobulaire.
Figure 20.10 Arbre décisionnel : prise en charge thérapeutique des carcinomes intracanalaires
4 . 2 . 3 . 2 - Traitement
- Prise en charge chirurgicale conservatrice (zonectomie ou tumorectomie) ou radicale (mammectomie) en fonction de la taille lésionnelle, du nombre de foyer, et du volume des seins. La marge de tissus sains tout autour du carcinome doit être au moins ≥ 2 mm.
- Si tumorectomie : radiothérapie systématique au niveau du sein après l’intervention.
4 . 2 . 4 - Prise en charge des carcinomes infiltrants (figures 20.11 et 20.12)
4 . 2 . 4 . 1 - Bilan d’extension (recommandations de l’Institut National du Cancer de juillet 2012)
La taille de la tumeur et l’envahissement ganglionnaire sont les deux principaux facteurs prédictifs de métastases asymptomatiques.
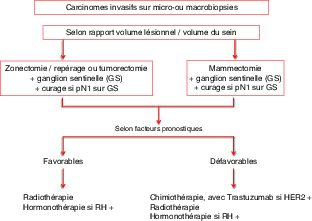
Figure 20.11 Arbre décisionnel : prise en charge thérapeutique des carcinomes invasifs opérables d’emblée
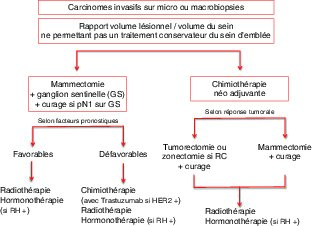
Figure 20.12 Arbre décisionnel : prise en charge thérapeutique des carcinomes invasifs ne permettant pas un traitement conservateur d’emblée
Les sites métastatiques préférentiels sont : les ganglions axillaires, les os, les poumons et le foie.
- Pas de bilan d’extension préopératoire si :
- Bilan d’extension seulement si :
- Dans ce cas, le bilan de première intention peut reposer sur l’une des trois options suivantes :
Pour information
La réalisation d’une IRM cérébrale systématique, dans le cadre du bilan initial, chez des patientes asymptomatiques atteintes de tumeurs sur exprimant HER2 n’est pas justifiée.
Le dosage du CA 15–3 est utile car sa valeur servira de référence pour la surveillance lorsque le taux initial est supérieur à la normale.
4 . 2 . 4 . 2 - Stadification de la maladie (tableau 20.5)
Elle est systématique avant l’établissement du protocole thérapeutique.
Tableau 20.5 Classification TNM
| Tumeur primaire T | Tx : la tumeur primitive ne peut pas être évaluée T0 : la tumeur primitive n’est pas palpable Tis : carcinome in situ T1 : tumeur ≤ 2 cm T1mic : micro-invasion ≤ 1 mm -T1a : 1 mm < tumeur ≤ 5 mm -T1b : 5 mm < tumeur ≤ 1 cm -T1c : 1 cm < tumeur ≤ 2 cm T2 : 2 cm < tumeur ≤ 5 cm T3 : tumeur > 5 cm T4 : tumeur, quelle que soit sa taille, avec une extension directe soit à la paroi thoracique (a), soit à la peau (b) -T4a : extension à la paroi thoracique en excluant le muscle pectoral -T4b : œdème (y compris peau d’orange) ou ulcération de la peau du sein, ou nodules de perméation situés sur la peau du même sein -T4c : T4a + T4b -T4d : cancer inflammatoire |
| Ganglions lymphatiques régionaux N | Nx : l’envahissement des ganglions lymphatiques régionaux ne peut pas être évalué N0 : absence d’envahissement ganglionnaire N1mi : micrométastases > 0,2 mm et ≤ 2 mm N1 : adénopathies axillaires homolatérales mobiles N2 : adénopathies axillaires homolatérales fixées N3 : adénopathies mammaires internes |
| Métastases à distance | Mx : aucune information sur les métastases M0 : pas de métastase M1 : métastases à distance (y compris ADP sus-claviculaire) |
Tableau 20.5 Classification TNM
4 . 2 . 4 . 3 - Traitement
Les traitements ont pour objectif de :
- faire l’exérèse de la tumeur et/ou traiter les métastases ;
- réduire le risque de récidive ;
- ralentir le développement de la tumeur ou des métastases ;
- améliorer le confort et la qualité de vie de la personne malade, en traitant les symptômes engendrés par la maladie.
Chirurgie
Chirurgie en première intention si tumeur opérable d’emblée, non métastatique et non inflammatoire (figure 20.11) :
- Sein :
- Aire axillaire :
Traitement chirurgical lorsque le rapport volume tumoral/volume du sein ne permet pas un traitement conservateur d’emblée (figure 20.12) : il existe alors deux options thérapeutiques :
soit mammectomie + curage axillaire ;
soit chimiothérapie néo-adjuvante : le traitement comporte en général 6 cycles avec un suivi de la réponse tumorale par l’examen clinique et l’imagerie (IRM +++) (figure 20.13) :
− réponse tumorale insuffisante : mammectomie + curage axillaire,
− réponse tumorale permettant un traitement conservateur (en cas de réponse complète (RC), avec disparition de la tumeur, ou de réponse partielle mais avec un rapport volume tumoral/volume du sein devenu favorable pour la conservation du sein) : tumorectomie, ou zonectomie + curage axillaire.
Figure 20.13 Intérêt de l’IRM en cas de chimiothérapie néoadjuvante
Radiothérapie
- Radiothérapie du sein restant (systématique) ou de la paroi thoracique (si mammectomie et tumeur localement évoluée) et des aires ganglionnaires (en cas d’envahissement ganglionnaire).
- Pas de radiothérapie du creux axillaire si curage axillaire réalisé, en raison du risque de lymphœdème et de l’absence de bénéfice sur le contrôle local et la survie.
Traitements médicaux
- Chimiothérapie :
- Hormonothérapie : si récepteurs hormonaux positifs (traitement pendant 5 ans) :
4 . 2 . 4 . 4 - Surveillance
Elle comporte :
- une prise en charge conjointe par : chirurgien, oncologue, médecin généraliste et/ou gynécologue ;
- un examen clinique biannuel avec mammographie et échographie annuelles pendant les 5 premières années, avec si besoin réalisation d’une IRM mammaire, puis bilan annuel ;
- un dosage du CA 15–3 seulement si contexte métastatique (CA 15–3 initialement élevé) ;
- une surveillance de la tolérance de l’hormonothérapie en raison de ses effets secondaires :
4 . 2 . 4 . 5 - Consultation d’oncogénétique
Cette consultation nécessite le consentement éclairé et écrit de la patiente.
Elle peut être utile à chaque fois qu’existe un contexte héréditaire. Le but de la consultation est la recherche d’une mutation portant sur BRCA 1 ou BRCA 2 devant des antécédents familiaux évocateurs, comportant :
- au moins 3 cancers chez des personnes apparentées au 1er et 2e degré ;
- au moins 2 cancers chez des personnes apparentées au 1er degré ± un des critères suivants :
4/5