5 - Hypercortisolisme et corticothérapie
L’ostéoporose vertébrale est une des complications classiques d’un excès de corticoïdes, surtout chez la femme. Elle est souvent silencieuse, avant l’apparition de tassements vertébraux « en salve », et doit faire l’objet d’une prévention systématique.
A. Physiopathologie de l’atteinte osseuse
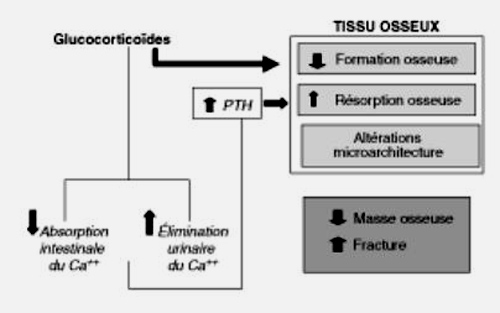
Les effets osseux des glucocorticoïdes sont complexes, résultant d’effets directs sur le tissu osseux et d’effets indirects sur l’homéostasie calcique et la production des stéroïdes sexuels (figure 8.4). Au niveau du tissu osseux, les corticoïdes diminuent la fonction et le nombre des ostéoblastes en diminuant l’ostéoblastogenèse, et en favorisant leur apoptose et celle des ostéocytes, qui ont un rôle important dans la qualité de l’os. Ils favorisent par ailleurs l’activité ostéoclastique et donc la résorption osseuse par différents mécanismes, telles une augmentation de la production du RANKL (facteur de l’ostéoclastogenèse) et une diminution de l’ostéoprotégérine (OPGR), inhibiteur de l’ostéoclastogenèse. La réduction de l’absorption intestinale du calcium et l’augmentation des pertes urinaires de calcium, induites par l’excès de glucocorticoïdes, favorisent par ailleurs un hyperparathyroïdisme secondaire dont les conséquences osseuses sont encore amplifiées par l’augmentation de la sensibilité des cellules osseuses à la PTH. Enfin, un taux excessif de glucocorticoïdes favorise un hypogonadisme et peut, dans certaines causes, diminuer également la production des androgènes surrénaliens.
Effets sur le tissu osseux et le métabolisme phosphocalcique (Ca++).
L’ostéoporose induite par l’hypercorticisme est essentiellement une ostéoporose à bas niveau de remodelage (diminution de l’ostéocalcine et autres marqueurs de l’ostéoformation), mais avec tendance à l’hyperrésorption. De plus, au plan histomorphométrique, la diminution du volume osseux s’accompagne d’altérations de la microarchitecture trabéculaire (amincissement des travées) qui contribuent à augmenter la fragilité osseuse sur les sites osseux riches en os trabéculaire.
B. Masse osseuse et risque fracturaire
La diminution de la masse osseuse intéresse surtout les sites trabéculaires, métaboliquement les plus actifs (corps vertébraux, côtes, radius), et apparaît de façon rapide, dans la première année de l’exposition aux corticoïdes. L’intensité de la perte osseuse reste difficile à prévoir au plan individuel. Par ailleurs, la phase prépubertaire (période cruciale pour l’acquisition d’un capital minéral osseux optimal) et l’hypogonadisme sont autant de conditions qui vont aggraver l’atteinte osseuse.
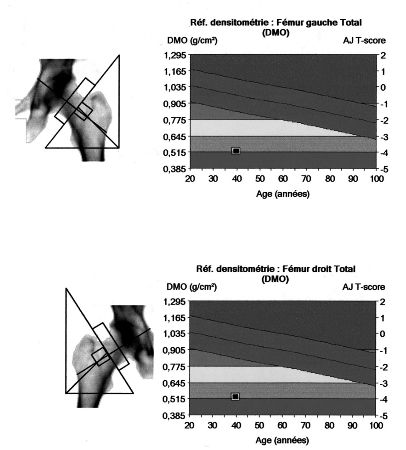
Les fractures vertébrales sont fréquentes chez les sujets exposés à un excès de glucocorticoïdes, et sont présentes chez 20 % à près de 80 % des sujets atteints d’un syndrome de Cushing lié à un adénome corticotrope ou à un adénome surrénalien (figures 8.5 et 8.6). Plusieurs études cas-témoins ont permis d’objectiver une augmentation du risque de fractures, surtout vertébrales, mais aussi non vertébrales chez les sujets ayant reçu une corticothérapie à partir de dose supérieure à 7,5 mg de prednisolone par jour. L’augmentation du risque fracturaire est liée à la diminution du contenu minéral osseux et aux altérations de la microarchitecture osseuse. La réversibilité de l’atteinte osseuse, après correction de l’hypercortisolisme ou arrêt de la corticothérapie, reste encore un sujet débattu en l’absence de données longitudinales suffisantes. Cependant, plusieurs données résultant soit d’observations individuelles, soit de l’étude de petits groupes de patients témoignent d’une amélioration de la densité osseuse après traitement du syndrome de Cushing, mais certains patients conservent une masse osseuse diminuée, notamment les adolescents et les patients les plus âgés.
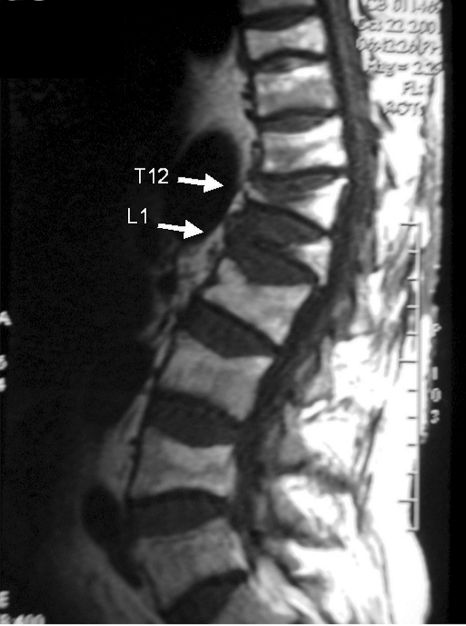
Tassements vertébraux étagés de T12 à L5, avec notamment 2 tassements cunéiformes majeurs de T12 et L1.
C. Prévention et traitement
Chez les sujets devant débuter une corticothérapie, la prévention de l’ostéoporose justifie, avant le traitement, une évaluation précise du statut osseux (mesure de la DMO vertébrale et fémorale), et une recherche de tous les facteurs de risque (statut nutritionnel et vitaminocalcique, activité physique, tabagisme, hypogonadisme, etc.) pouvant être corrigés. La dose de corticoïdes sera la plus faible possible, en donnant la préférence, chaque fois que possible, aux voies non orales et aux molécules à durée de vie courte.
Il faut proposer systématiquement une supplémentation vitaminocalcique. Les doses de calcium prescrites dépendent des apports alimentaires et, dans le syndrome de Cushing, de la calciurie, souvent élevée. Quatre médicaments sont nommément remboursés dans l’ostéoporose cortisonique : l’étidronate en prise séquentielle de 400 mg/j pendant 14 jours tous les 3 mois ; le risédronate en prise quotidienne de 5 mg (chez les femmes ménopausées) ; le zolédronate en injection intraveineuse annuelle de 5 mg (chez les femmes ménopausées et les hommes à risque élevé de fracture) et le tériparatide en injection sous-cutanée quotidienne. Par ailleurs, si on se réfère aux recommandations de la Haute Autorité de Santé pour le traitement médicamenteux de l’ostéoporose postménopausique, d’autres traitements peuvent être proposés sans déroger aux conditions de remboursement chez les femmes ménopausées s’il existe déjà une fracture par fragilité osseuse (quel que soit le T-score) ou bien si le T-score est inférieur ou égal à ? 2,5, car la corticothérapie systémique ancienne ou actuelle à une dose supérieure ou égale à 7,5 mg/jour équivalent prednisone est un facteur de risque : l’alendronate (en prise quotidienne ou hebdomadaire, seul ou associé à la vitamine D), le risédronate (en prise hebdomadaire de 35 mg ou 2 jours par mois à 75 mg) ou le ranélate de strontium (en prise quotidienne).