- Pré-requis et Objectifs
- Cours
- Annexes
- Votre Avis
- Ressources Enseignants
5 - Étiologies de l’infertilité du couple
5 . 1 - Chez la femme
1. Anovulations et dysovulations
Les ovulations de mauvaise qualité sont caractérisées par une phase lutéale courte et/ou défectueuse, avec une sécrétion insuffisante de progestérone.
C’est une cause très fréquente d’infertilité féminine (près de 20 % des cas d’infécondité du couple). Leur diagnostic est le plus souvent évident devant l’existence d’une aménorrhée ou d’irrégularités menstruelles (cf. chapitre 19 : « Aménorrhée »), mais des cycles réguliers n’éliminent pas une anovulation. La courbe ménothermique ou un dosage de progestérone en deuxième partie de cycle doit être systématique.
Pour les anovulations, par fréquence décroissante, il peut s’agir (cf. aussi chapitre 19 : « Aménorrhée ») :
- d’un syndrome des ovaires polymicrokystiques (anovulation chronique avec élévation des androgènes ou élévation du rapport LH/FSH, insulinorésistance, échographie ovarienne) ;
- d’une hyperprolactinémie ;
- d’une insuffisance ovarienne primitive (FSH élevée, estradiol bas ; intérêt possible du dosage d’AMH [hormone antimullérienne] et du nombre de follicules antraux à l’échographie ovarienne) ;
- ou d’un déficit gonadotrope (FSH et LH basses), dont il faudra déterminer l’étiologie ;
- d’une cause psycho-nutritionnelle (stress, activité physique intense, restriction alimentaire et pondérale).
Plus rarement, c’est une cause endocrinienne qui sera retrouvée : dysthyroïdie (surtout hypothyroïdie) ou hyperandrogénie surrénalienne.
L’existence d’une insuffisance ovarienne primitive amène à proposer un don d’ovocytes ; le seul traitement recommandé (GEDO, groupe d’étude du don d’ovocytes) est un traitement substitutif associé à de rares reprises spontanées de l’ovulation avec grossesse.
2. Obstacles mécaniques
a. Anomalies du col utérin et insuffisance de glaire cervicale
Elles sont la conséquence de sténoses cervicales apparues après conisation, curetage ou diathermocoagulation de l’endocol. Ces lésions peuvent être responsables d’une pathologie de la glaire cervicale et constituent l’indication de choix aux inséminations intra-utérines avec sperme du conjoint (IAC).
En dehors de ces cas, les causes responsables d’une absence de glaire sont difficiles à identifier (pathologie infectieuse ?). Les causes endocriniennes se résument aux anovulations mais, dans ce cas, il existe presque toujours une aménorrhée.
b. Obstacle utérin
Ce sont les malformations utérines avec cloisonnement, ou des synéchies infectieuses ou secondaires à des manœuvres endo-utérines du post-partum ou après une interruption de grossesse. La visualisation de la cavité utérine par hystéroscopie permet le diagnostic et parfois le traitement (synéchie de petite taille).
Dans d’autres cas, il peut s’agir de polypes muqueux, de fibromes sous-muqueux ou d’une hyperplasie endométriale. Le rôle de ces anomalies dans l’infertilité doit être regardé de façon critique car, en dehors d’un volumineux fibrome sous-muqueux, elles expliquent rarement l’infertilité.
L’existence d’un endomètre fin < 5 mm par hypoestrogénie doit faire rechercher un utérus irradié lors d’un traitement de cancer de l’enfant avec séquelles importantes de la vascularisation ; on peut dans ces cas étudier par doppler couleur les résistances vasculaires des artères utérines.
c. Obstacle tubaire
Il s’agit d’une cause majeure d’infertilité féminine +++. Le plus souvent l’obstacle tubaire est secondaire à une salpingite (parfois passée inaperçue), un traumatisme chirurgical ou une endométriose.
Le diagnostic repose sur l’hystérosalpingographie qui montre l’obstacle, son caractère uni ou bilatéral, ou l’existence de diverticules évocateurs d’endométriose.
La cœlioscopie, comprenant une épreuve de perméabilité au bleu, permet de faire au mieux l’inventaire des lésions, donc de mieux préciser le pronostic et de réaliser en outre des gestes thérapeutiques. Elle est également réalisée en cas d’infertilité inexpliquée, permettant parfois de mettre en évidence des foyers d’endométriose.
3. Endométriose
a. Cause fréquente d’infertilité ?
Une endométriose modérée, asymptomatique n’est pas la cause de l’infertilité. Des lésions endométriosiques sont retrouvées chez 50 % des femmes consultant pour « infertilité idiopathique ».
b. Cœlioscopie non systématique
Le diagnostic est parfois évoqué devant l’existence de douleurs pelviennes, soit menstruelles, soit coïtales (dyspareunie profonde), ou après réalisation d’une hystérographie qui montre des images plus ou moins typiques (diverticules du segment interstitiel des trompes = images en « boule de gui », images d’angulation ou de rétention ampullaire).
L’hystérographie peut cependant être normale, ce qui justifie la réalisation d’une cœlioscopie chez une femme présentant une infécondité inexpliquée lorsqu’il y a des signes d’appel. Cette dernière montrera des foyers d’endométriose (grains bleutés) plus ou moins nombreux, uni ou bilatéraux, souvent localisés au niveau de l’isthme, mais toutes les localisations sont possibles, y compris dans le péritoine ou les ovaires. La cœlioscopie permet de préciser le stade de l’endométriose, d’en découvrir les sites lésionnels et de la traiter. L’endométriose ovarienne (endométriome) est responsable de kystes ovariens visibles en échographie. Une chirurgie peut être proposée si leur taille est > 5 cm (discutée). L’endométriose extragénitale, qui est responsable de douleurs digestives, urinaires, est bien évaluée par IRM. Des traitements médicaux de l’endométriose sont possibles en complément de la chirurgie (analogues de la GnRH [hormone libératrice de la gonadotrophine]).
5 . 2 - Chez l’homme
1. Oligo-asthéno-térato-spermies (OAT)
Elles représentent une des causes les plus fréquentes d’infécondité masculine.
a. Diagnostic
Il repose sur la réalisation de plusieurs spermogrammes montrant une diminution du nombre et de la mobilité des spermatozoïdes, associée à une fréquence élevée de formes anormales.
Les OAT constituent un simple symptôme dont les causes sont très variées.
L’enquête étiologique chez ces patients est similaire à celle utilisée chez les sujets atteints d’azoospermie. Chez près de 10 % des patients atteints d’OAT extrême (< 5 '106 spermatozoïdes/mL), un caryotype doit être demandé et des microdélétions du bras long du chromosome Y ont été mises en évidence.
b. Traitement
Leur traitement fait souvent appel à un traitement antibiotique anti-inflammatoire lorsqu’il y a des signes évidents d’infection clinique et des polynucléaires nombreux lors du spermocytogramme (> 106/mL), ainsi qu’une biochimie séminale perturbée (abaissement des marqueurs), ou un ECBU (examen cytobactériologique des urines) positif sur des germes (recherche spécifique de Chlamydiae), ou une spermoculture positive spécifique sur un germe. Mais cela reste rare.
Le plus souvent, ce sera le recours à une technique d’assistance médicale à la procréation : IAC (inséminations avec le sperme du conjoint réalisées en intra-utérin), FIV (fécondation in vitro), ICSI (injection intracytoplasmique du spermatozoïde), en particulier lors d’un problème immunologique ou d’une mobilité très basse ou absente. À titre indicatif, on considère que les IAC sont réalisables si N > 106 (N étant le nombre de spermatozoïdes mobiles) sont récupérés après les techniques de lavage et de concentration (swim up, gradient de Percoll) ; une FIV si N > 500 000 et une ICSI si N < 500 000.
Il a été proposé récemment de ne pas effectuer de prise en charge par AMP en cas d’infertilité chez les femmes âgées de plus de 43 ans, et les hommes de plus de 59 ans.
2. Azoospermies
Trois éléments guident la réflexion : le volume testiculaire, les signes d’hypoandrisme et les taux de FSH. Il ne faut pas oublier les antécédents de cryptorchidie.
a. Azoospermies sécrétoires ou non obstructives
Elles sont définies par l’absence de production de spermatozoïdes par les testicules.
- Diagnostic
L’azoospermie est toujours non obstructive lorsque le volume testiculaire est faible et la concentration plasmatique de FSH élevée et d’inhibine B abaissée. Chez ces patients, le caryotype permet le plus souvent le diagnostic de syndrome de Klinefelter (formule caryotypique 47 XXY).
Cependant, des patients porteurs d’authentiques azoospermies sécrétoires peuvent présenter un volume testiculaire et des concentrations plasmatiques de FSH et d’inhibine B proches de la normale.
- Étiologies
L’analyse moléculaire du bras long du chromosome Y permet de mettre en évidence des microdélétions des régions AZF (azoospermia factor) chez 18 à 38 % de ces patients.
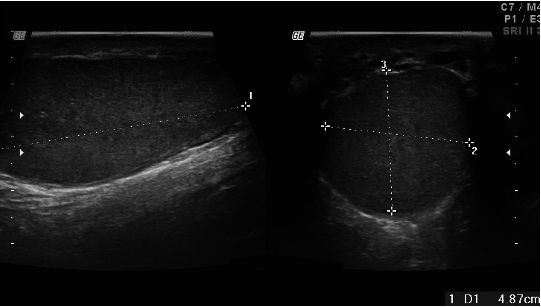
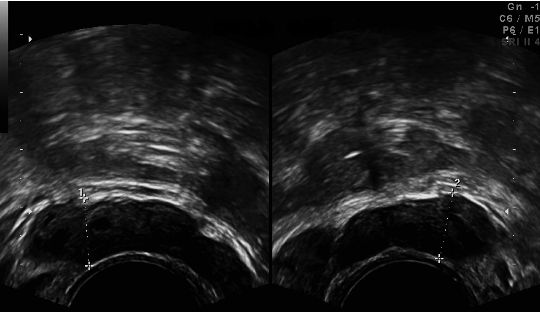
Une échographie testiculaire (figure 4.5) permet d’éliminer un cancer testiculaire, plus fréquent dans ces cas. Une exploration chirurgicale avec biopsie testiculaire permet parfois de réaliser une ICSI.
Fig. 4.5. Échographiestesticulaires et des organes génitaux internes : a – Échographie testiculaire normale.
Fig. 4.5. Échographiestesticulaires et des organes génitaux internes : b – Échographie des voies spermatiques : présence de deux vésicules séminales normales
Les déficits gonadotropes sont aussi une cause d’azoospermie non obstructive mais, chez ces patients, c’est le tableau d’hypogonadisme qui domine et le diagnostic est confirmé par les dosages hormonaux. Dans la grande majorité des cas, ces patients consultent pour un impubérisme ou des troubles de la libido et non pour une infertilité. Il s’agit d’une cause rare (< 5 %) mais curable par un traitement médical simple.
b. Azoospermies excrétoires ou obstructives
Elles sont la conséquence d’une obstruction des voies excrétrices.
- Diagnostic
Ce diagnostic est toujours évoqué lorsque le volume gonadique et la concentration plasmatique de FSH et d’inhibine B sont normaux et le volume séminal abaissé.
Un examen clinique soigneux de l’appareil excréteur (épididymes, déférents, vésicules séminales et prostate), complété par une échographie endorectale (cf. chapitre 1 : « Indications et stratégies d’utilisation des principaux examens d’imagerie ») et des dosages des paramètres biochimiques du liquide séminal aideront à préciser le niveau de l’obstruction.
- Principales étiologies
Parmi les causes congénitales, il faut insister sur les agénésies bilatérales des canaux déférents. Le diagnostic repose sur la non-perception de canaux déférents à la palpation, associée à une distension de la tête et une atrophie du corps de l’épididyme, confirmées à l’échographie (cf. chapitre 1).
Cette affection est le plus souvent secondaire à une anomalie hétérozygote du gène CFTR (cystic fibrosis transmembrane conductance regulator), responsable de la mucoviscidose. Dans sa forme homozygote, le diagnostic est évident devant des anomalies de la fonction pancréatique exocrine, des infections bronchopulmonaires sévères et une agénésie congénitale des déférents, responsable d’azoospermie. Il existe cependant des formes génitales isolées où le diagnostic, fortement suspecté par l’agénésie des différents échographie, ne pourra être fait que par l’analyse moléculaire du gène CFTR, conduisant à un conseil génétique (+++) et à une exploration de la conjointe en raison de la fréquence des formes hétérozygotes dans la population générale.
Les obstacles épididymaires acquis, dont l’origine infectieuse n’est le plus souvent que présumée (gonocoque, tuberculose, Chlamydiae), représentent l’étiologie principale des azoospermies excrétoires. Chez ces patients, le déférent est souvent palpable, parfois gros ou présentant des nodules.
c. Exploration chirurgicale testiculaire et des voies excrétrices
Elle est réalisée après confirmation de l’azoospermie et suite au bilan d’orientation (excrétoire/sécrétoire) et au bilan génétique (caryotype, recherche de microdélétion du chromosome Y en cas d’azoospermie sécrétoire avec FSH élevée, et recherche de mutation du gène CFTR en cas d’azoospermie à FSH normale).
L’exploration aura pour but de vérifier l’intégrité des voies excrétrices, de prélever des spermatozoïdes dans l’épididyme en vue d’une ICSI et/ou de réaliser des biopsies testiculaires en vue d’une analyse histologique diagnostique. Cette dernière permettra de préciser le niveau d’un blocage éventuel de la maturation ou d’une disparition plus ou moins complète de la lignée germinale (azoospermie sécrétoire) et, si possible, une utilisation par ICSI après congélation préalable en cas de présence de spermatozoïdes testiculaires.
La reperméabilisation déférentielle, après vasectomie intentionnelle (utilisée dans un but contraceptif), est possible dans certains cas, mais s’accompagne souvent d’une infertilité secondaire à la présence d’anticorps anti-spermatozoïdes, rendant nécessaire une ICSI. La vasectomie ne peut donc être considérée comme un acte chirurgical réversible. Il est préférable de conseiller préalablement à ces patients une cryopréservation du sperme.
5/5