Chapitre 2 : Liaison chimique
Définition : Le modèle de Lewis pour les atomes
Dans le modèle de Lewis, seuls les électrons de valence sont pris en compte. On identifie chaque électron de valence autour du symbole de l'atome. Les électrons célibataires dans leur case quantique sont notés par un point et les électrons formant une paire dans chaque case quantique sont notés par un trait : c'est un doublet électronique.
La démarche est la suivante :
identifier les électrons de valence dans la configuration électronique
écrire les électrons dans leur cases quantiques
ajouter autour du symbole chimique autant de points que d'électrons célibataires et autant de traits que de paires d'électrons.
Définition : La notion de valence
La valence d'un élément correspond en fait à son nombre d'électrons célibataires.
Une ou des valence(s) dites « secondaires » peuvent s'observer sur certains éléments si ils possèdent des cases quantiques vides partageant le même nombre quantique que les OA de valence. Les doublets non-liants dans les électrons de valence peuvent alors se séparer en 2, en empruntant ces cases quantiques vides.
L'atome de carbone peut avoir une valence de 2 ou alors passer en état de valence secondaire qui vaut 4. L'atome de Phosphore ou celui de soufre peuvent aussi avoir des valences secondaires.
Définition : La liaison covalente
La mise en commun d'électrons célibataires entre 2 atomes va créer une ou des liaisons chimiques. Ces liaisons seront alors représentées par un trait entre les 2 atomes, on parlera de liaison covalente.
Les doublets déjà présents sur les atomes ne se mélangent pas et restent localisés sur leur atome d'origine, on parle de doublet non-liant.
Définition : La liaison par coordinence
En combinant un doublet non-liant (contenant 2 électrons), et une case quantique vide, on crée une « liaison par coordinence ».
Définition : La liaison ionique
Lorsque la différence d'électronégativité entre deux atomes est importante, la liaison entre ces derniers peut aussi s'expliquer par une interaction qui est dominée par le caractère électrostatique. On parle alors de liaison ionique, comme si la liaison avait lieu entre des ions de charges opposées. On peut par exemple représenter la molécule NaCl par le composé [Na+; Cl-]
Définition : Structure tridimensionnelle des molécules
Notation de Cram
Une liaison dans le plan : 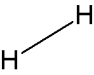
Une liaison vers l'avant du plan : 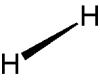
Une liaison vers l'arrière du plan : 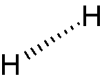
Théorie VSEPR
La théorie VSEPR (Valence Shell Electron Pair Repulsion) permet de prédire la structure tridimensionnelle d'une molécule.
La règle générale est que les paires d'électrons de valence se disposent autour d'un atome central de manière à minimiser leurs répulsions.
Ici, une paire d'électrons peut se définir comme :
une connexion chimique vers un autre atome (une simple, une double ou une triple liaison sont considérées comme une paire unique)
un doublet non-liant
Le type VSEPR de l'atome central se note AXnEm. A est l'atome central, n un entier positif qui correspond au nombre d'atomes (X) liés à l'atome A, m est le nombre de doublets non-liants (E) portés par l'atome A.
La répartition de l'ensemble des n groupements X ou m groupements E dans l'espace autour de l'atome A dépend uniquement de leur nombre (n+m).
Un chapitre très détaillé associé à ce concept peut etre consulté sur
http://uel.unisciel.fr/chimie/strucmic/strucmic_ch05/co/apprendre_01_1.html
Seuls quelques rappels sont abordés ici.
La géométrie de la molécule tient compte du fait que les doublets non-liants ne sont pas directement détectables.
Dans la réalité, les doublets non-liants de l'atome central sont plus volumineux que les liaisons vers d'autres atomes. En conséquence, les formes très symétriques de la théorie VSEPR peuvent être légèrement déformées pour tenir compte de cette particularité. Les doublets non-liants vont avoir tendance à repousser davantage les atomes périphériques et ainsi faire diminuer l'angle XAX qui les sépare.







