Chapitre 1 : Interactions rayonnement / matière, structure de l'atome
Définition : Les ondes électromagnétiques
La lumière est une onde électromagnétique qui se propage dans le vide à la vitesse de 3.108 m.s-1. Cette valeur est une constante, appelée « célérité », et notée c.
La lumière revêt un caractère ondulatoire et elle est décrite par sa longueur d'onde λ exprimée en mètre (m) et sa fréquence v exprimée en Hertz (Hz). On retiendra :
![]()
Notre oeil n'est sensible qu'aux ondes dont la longeur d'onde se situe environ entre 400 (~ violette) et 750 nm (~ rouge).
La lumière, en tant que rayonnement électromagnétique est aussi une forme d'énergie. Cette énergie est transportée par des « photons ». Chaque photon transporte un « quantum » d'énergie. La quantité d'énergie transportée par un photon de longueur d'onde λ est proportionnelle à cette longueur d'onde.
E = h.v
h est une constante fondamentale, dite constante de Planck ; elle vaut 6,62.10-34 J.Hz-1 ou J.s.
On remarque que, pour une onde électreomagnétique :
![]()
Définition : L'électron dans l'atome
Les éléments « hydrogènoïdes » représentent l'ensemble des atomes ou ions qui ne possèdent qu'un seul et unique électron. L'énergie totale dépend d'un nombre entier, appelé « n ». Cette énergie, en plus d'être négative, est discontinue ou encore quantifiée.
Dans ces éléments hydrogènoïdes, cette énergie se calcule avec la relation suivante :
![]()
h est la constante de Planck, c, la vitesse de la lumière, Z, le numéro atomique de l'atome et n, le niveau sur lequel se trouve l'électron. Rh vaut 1,1.107 m.
Dans une unité alternative, appelée eV (electron-Volt ; 1 eV = 1,6.10-19 J), cette relation devient ![]()
On peut représenter les niveaux d'énergies accessibles à l'électron comme sur le schéma suivant.
Évolution de l'énergie d'un électron dans un atome. Cette énergie dépend d'un nombre quantique (n) compris entre 1 (énergie la plus faible dans l'atome) et ∞ (E∞ = 0).
Par défaut, l'unique électron d'un élément hydrogénoïde se trouve sur le niveau n = 1. Cet état est l'« état fondamental »
L'électron est capable de « sauter » vers d'autres états (n différents de 1) si on lui apporte de l'énergie.
Définition : Interaction électron / onde électromagnétique
Absorption
Des photons peuvent être absorbés par l'électron, impliquant une augmentation de son énergie. Toutefois, L'électron n'absorbera le photon que si celui-ci lui permet d'atteindre exactement un niveau d'énergie quantifié. On parlera alors de transition électronique. L'énergie permettant une transition électronique entre un niveau inférieur n et un niveau supérieur n' s'écrit :
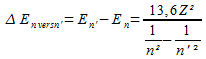
Si l'énergie de l'électron augente, on parlera d'excitation électronique. Si un photon ne transporte pas exactement l'énergie correspondant à la différence entre l'énergie de l'électron et un état « n' », celui-ci ne sera pas absorbé.
Si l'énergie Ehw du photon absorbé dépasse une certaine limite, l'énergie de l'électron peut même devenir positive. On parle de seuil d'ionisation. Ce seuil correspond au niveau n = ∞. Cette énergie positive sera totalement transformée en énergie cinétique :
![]()
Émission
L'électron, de manière générale, va évoluer vers son état d'énergie la plus faible, à savoir E1 dans un atome hydrogénoïde. Ce phénomène s'appelle désexcitation électronique.
Lors de ce phénomène, l'électron va emmètre de l'énergie sous forme de lumière
Fondamental : Description de l'électron
Le nombre quantique de spin, « s »
L'électron possède une propriété magnétique. Cette propriété de l'électron s'appelle le « spin ».
Un électron peut avoir un spin qui vaut +1/2, ou un spin qui vaut -1/2. Ce sont les 2 seules valeurs possibles.
Le nombre quantique principal, « n »
Le nombre « n » vu précédemment est appelé nombre quantique principal. n peut prendre toutes les valeurs entières jusqu'à l'infini.
Le nombre quantique secondaire, « l »
Un électron représenté par une valeur de « n » donnée, ne peut avoir que des valeurs de « l » comprises entre 0 et (n – 1).
La valeur du nombre 'l' décrit la forme de la zone de l'espace dans laquelle la probabilité de trouver l'électron n'est pas nulle. On appelle cette zone, une orbitale atomique.
La forme de l'orbitale atomique (OA) est représentée dans le tableau suivant. Chaque type d'OA est associé à une lettre :
l | OA |
0 | s |
1 | p |
2 | d |
Si l = 3, on parlera d'orbitale de type « f ».
Le nombre quantique magnétique, « ml »
La valeur de ml définit la direction dans laquelle est dirigée l'orbitale atomique :
si l = 0, alors ml = 0 et il n'y a pas de direction particulière. Les OA de type 's' ont des symétries sphériques.
si l = 1, il peut y avoir 3 valeurs de ml (-1, 0 ou 1). Il y a donc 3 OA possibles sur chaque sous-niveau d'énergie où l = 1. On parle d'OA de type 'p'. Les 3 OA correspondantes pointeront dans 3 directions différentes dans l'espace : px, py et pz. Ces 3 orbitales ont la même énergie, elles sont dites dégénérées.
si l = 2, on aura lors 5 valeurs de m possibles (-2, -1, 0, 1 ou 2). On parlera d'OA de type dxy, dyz, dxz , dx²-y², et dz². Ces 5 orbitales sont aussi dégénérées.
Les valeurs de m ne sont pas nécessairement associées à une direction particulière, dans la mesure où ce choix est totalement arbitraire. En effet, la valeur de ml ou la direction de l'OA dans l'espace n'a aucune influence sur l'énergie de l'OA.
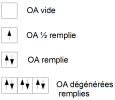
Cases quantiques
Une case quantique schématise une Orbitale Atomique, elle représente un jeu unique de valeur pour n, l et ml. Un électron dans cette case est représentée par une flèche vers le haut pour s= +1/2 ou vers le bas pour s = -1/2.
Notation des orbitales atomiques
La notation des OA se fait en précisant les valeurs de n l et m, selon la forme :
« valeur de n - symbole associé à l - direction associée à ml »
Le schéma ci-dessous regroupe les différentes OA et leur classement énergétique.
Définition : Principe d'exclusion de Pauli
Les électrons ne peuvent pas partager exactement les 4 mêmes nombres quantiques.
Il en suit :
Pour chaque valeur de l = 0 (OA de type 's'), on ne trouvera qu'une case quantique et elle ne contiendra que 2 électrons au maximum
Pour chaque valeur de l = 1 (OA de type ‘p'), on trouvera 3 cases quantiques (px, py et pz), qui contiendront chacune 2 électrons au maximum, soit 6 (3*2) électrons au maximum pour un niveau 'p'
On trouvera 10 (5*2) électrons au maximum pour un niveau 'd'
On trouvera 14 électrons au maximum pour un niveau 'f'
Définition : Configuration électronique
La configuration électronique d'un élément représente la façon dont les électrons sont distribués sur les OA de l'atome.
On la note :
[X] = 1s² 2s² 2p6 3s² 3p6....,
jusqu'à ce que tous les électrons soient associés à une orbitale atomique. On retrouve donc la notation des OA, sur lesquelles on spécifie le nombre d'électrons qu'elle contient en exposant.
Définition : Règle de Hund
Les électrons occupent les cases quantiques avec des valeurs de spin qui vont maximiser la valeur du spin total.
Ceci signifie que l'on va disposer un maximum d'électrons avec des valeurs spin qu'on dira 'parallèles', (dans le même sens) sans violer le principe de Pauli. Lorsque toutes les OA dégénérées comportent un électron, les autres électrons prennent alors des valeurs de spin opposés.
Définition : Règles de remplissage des OA
Les OA sont classées par valeur croissante de la somme de leur nombre quantique n et l :
Pour 2 OA ayant une valeur de 'n+l' identique, celle ayant le n le plus faible sera privilégiée, il en découle la hiérarchie suivante : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d ....
Définition : Exceptions dans la configuration électronique
Les exceptions concernent surtout les OA de type d :
Les configurations du Chrome (Z = 24) et du cuivre (Z = 29) se finissent en 4s13d5 pour le chrome et 4s1 3d10 pour le cuivre. Les configurations se finissant par 4s² 3d5 ou 4s² 3d9 ne sont jamais rencontrées.
Le remplissage total des OA de type ‘d' (d10) leur confère une grande stabilité, les faisant alors passer AVANT les orbitales ‘s'. On écrira par exemple 1s22s22p63s23p63d104s2.
Les cations formés à partir d'atomes dont les configurations se finissent par 4s²3dx ou 5s²4dx , etc, voient leur électrons des OA ‘s' arrachés AVANT ceux des OA de type d.
Définition : Couches de valence et de cœur
Les électrons de valence sont les électrons les plus périphériques d'un atome. Ces électrons sont dans des OA, qu'on appelle la couche de valence.
Cette couche de valence est l'ensemble des OA qui, dans la configuration électronique, se trouvent à droite de la première OA portant le nombre quantique n le plus élevé.
Définition : les électrons qui ne sont pas dans la couche de valence forment les couches de cœur.
Raccourci d'écriture de la configuration électronique
Le raccourcis d'écriture implique les atomes suivants, qui ont en commun d'avoir totalement rempli leur orbitales de valence: 2He, 10Ne, 18Ar, 36Kr et 54Xe. Ceci permte de réduite la notation des électrons de cœur à la configuration électronique de l'atome qui correspond au bon nombre d'électrons :
[X] = [Y] « électrons de valence », où Y est choisi parmi 2He, 10Ne, 18Ar, 36Kr et 54Xe
Définition : Tableau périodique
La tableau périodique regroupe les éléments par famille.
Familles d'éléments
Éléments alcalins
Ils ont une configuration électronique de valence de type ' ns1 ', avec n ≥ 2.
Ils correspondent à la première colonne du tableau périodique, à l'exception de l'atome d'hydrogène qui n'appartient pas à cette famille.
Ils ont une faible énergie d'ionisation et une petite affinité électronique. Ils deviendront facilement des mono-cations (X+).
Éléments alcalino-terreux
Ils ont une configuration électronique de valence de type 'ns²', avec n ≥ 2.
Ils correspondent à la deuxième colonne du tableau périodique.
Ils ont une 1re énergie d'ionisation assez élevée, mais en revanche un faible énergie de 2e ionisation ainsi qu'une petite affinité électronique. Ils deviendront facilement des di-cations (X2+).
Éléments halogènes
Ils ont une configuration électronique de valence de type 'ns² np5', avec n ≥ 2.
Ils correspondent à l'avant-dernière colonne du tableau périodique.
Ils deviendront facilement des mono-anions (X-).
Gaz rares ou gaz nobles
Ils ont une configuration électronique de valence de type 'ns² np6', avec n ≥ 1. L'hélium de configuration électronique [He] : 1s² appartient également à cette famille.
Ils correspondent à la dernière colonne du tableau périodique.
Ils ont déjà une couche de valence totalement remplie.
Métaux de transition
Ils ont une configuration électronique de valence de type '(n+1)s² ndx ' , avec n ≥ 3.
Ils appartiennent à la 3e, 4e et 5e ligne du tableau périodique. Ils ont plutôt tendance à perdre des électrons pour devenir des cations.
Bien que les derniers électrons de valence écrits appartiennent au niveau d, leur deux premières ionisations éjectent les électrons du niveau (n+1)s précédant le niveau nd.
On peut trouver une représentation complète du tableau avec les familles chimiques sur le site suivant :