- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Introduction
- 2 - Mécanismes fondamentaux
- 3 - Aspects épidémiologiques
-
4 - Aspects diagnostiques
- 4.1 - Diagnostic biologique
-
4.2 - Diagnostic clinique
-
4
.
2
.
1 - Les maladies auto-immunes systémiques ou non spécifiques d'organe
- 4 . 2 . 1 . 1 - Lupus Érythémateux Aigu Disséminé (LEAD) ou Systémique (LES)
- 4 . 2 . 1 . 2 - Sclérodermie
- 4 . 2 . 1 . 3 - Polymyosite et dermatopolymyosite
- 4 . 2 . 1 . 4 - Syndrome de Gougerot-Sjögren
- 4 . 2 . 1 . 5 - Syndrome de Sharp ou connectivité mixte
- 4 . 2 . 1 . 6 - Remarque sur les vascularites avec auto-anticorps
- 4 . 2 . 2 - Maladies auto-immunes spécifiques d'organe
-
4
.
2
.
1 - Les maladies auto-immunes systémiques ou non spécifiques d'organe
- 5 - Principes du traitement des maladies auto-immunes
- 6 - Surveillance au long cours d'une maladie auto-immune systémique
-
Version PDF

-
Contenu
- Evaluations
- Annexes
4 - Aspects diagnostiques
4 . 1 - Diagnostic biologique
4 . 1 . 1 - Les auto-anticorps les plus pertinents
Les aAc sont les principaux marqueurs immunologiques des maladies auto-immunes. Ils sont utiles dans trois circonstances : établir un diagnostic difficile, poser le diagnostic étiologique d'un syndrome ou suivre l'évolution d'une maladie auto-immune sous traitement. Par contre, ils ne peuvent pas servir d'outil de dépistage d'une maladie auto-immune donnée au sein de l'ensemble d'une population du fait de la faible prévalence de la maladie considérée et de la présence de quelques porteurs sains d'aAc dans la population normale.
Auto-anticorps chez l'individu sain
| Spécificité | % |
| Anti-cellules pariétales gastriques | 3-5 % |
| Anti-mitochondries | 1-4 % |
| Anti-muscle lisse | 3-6 % |
| Anti-thyroperoxydase | 7 % |
| Anti-thyroglobuline | 2-23 % |
| Facteur rhumatoïde | 4-14 % |
| Anti-nucléaires | 2-5 % |
| Anti-phospholipides | 2-15 % |
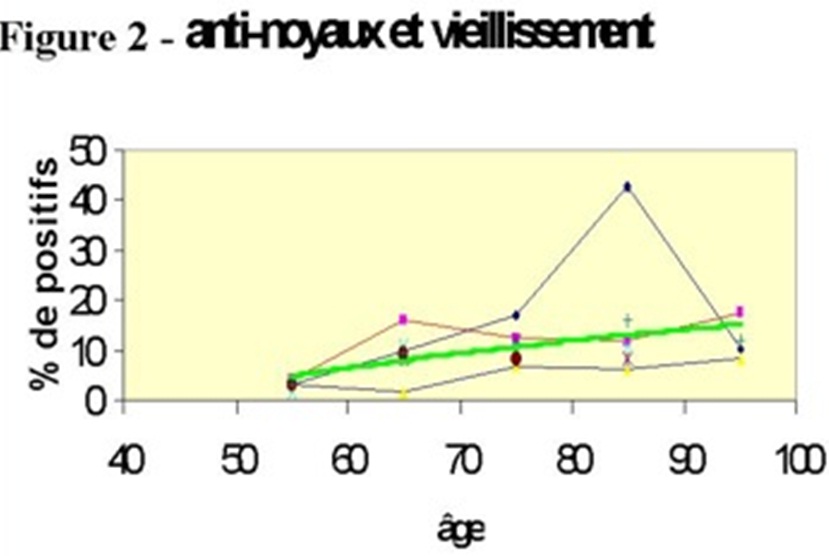
L'existence de l'auto-immunité « physiologique », qui se traduit par des taux faibles ou très faibles d'aAc chez l'individu normal, permet de bien comprendre la notion de seuil : un titre d'aAc inférieur à ce seuil n'aura pas de signification pathologique. Ce seuil est variable d'un aAc à un autre, selon la technique utilisée pour sa détection et, éventuellement, selon le sexe et l'âge (figure) ; il doit être signalé par le biologiste et pris en compte par le clinicien.
Anti-noyaux et vieillissement
Nous n'envisagerons ici que les aAc les plus pertinents sur le plan du diagnostic ; successivement les aAc anti-antigènes nucléaires, non spécifiques d'organe, les autres aAc non spécifiques d'organe et les aAc spécifiques d'organe ou, du moins, associés à des maladies auto-immunes spécifiques d'organe.
4 . 1 . 1 . 1 - Auto-anticorps anti-antigènes nucléaires
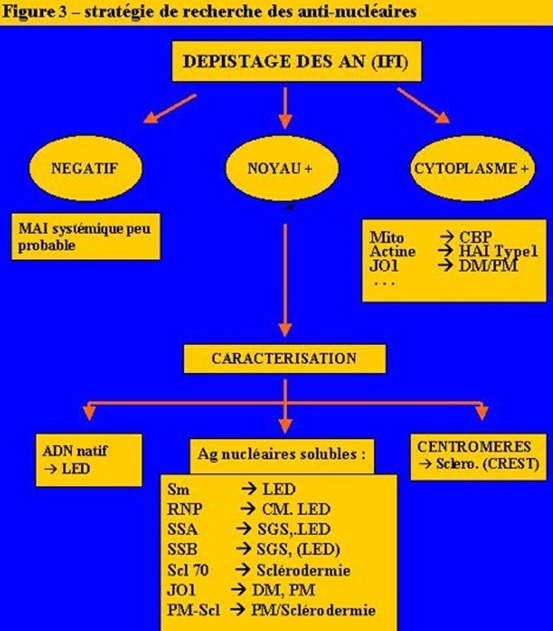
La recherche d'aAc anti-noyaux des cellules (AN) est le test de dépistage le plus sensible et le plus utilisé pour les maladies auto-immunes systémiques. Ce test utilise actuellement des cellules d'origine cancéreuses (HEp2) fixées sur une lame et la présence d'anticorps anti-nucléaires est révélée par une technique d'immunofluorescence indirecte. La positivité du test indique la présence d'anticorps dirigés contre un ou plusieurs antigènes nucléaires que l'on pourra ensuite caractériser par d'autres techniques. On peut déjà apprécier le type de fluorescence (homogène souvent associée à la présence d'anticorps anti-histone ou anti-ADN, périphérique plus évocatrice de la présence d'anti-ADN, mouchetée associée à la présence d'anticorps reconnaissant diverses nucléoprotéines solubles comme les Sm, les RNP, SS-A et SS-B et enfin nucléolaire ou centromérique au cours de la sclérodermie). Il faut aussi apprécier le titre des AN qui se définit par l'inverse de la dernière dilution du sérum testé pour laquelle ils restent positifs. Le seuil est fixé autour de 80 ou 100, voire plus haut, chez l'individu âgé, surtout la femme. Dans le lupus systémique, les AN sont présents dans plus de 90 % des cas et ils ont souvent des titres supérieurs à 500. Ces aAc peuvent toutefois être également observés dans d'autres maladies auto-immunes systémiques avec une fréquence assez élevée.
Les données de la littérature sont très discordantes (variations techniques, biais de recrutement, etc…) : de 13 à 96 % (!) au cours des sclérodermies, de 40 à 70 % dans le Syndrome de Gougerot-Sjögren, de 15 % à 30 % dans les dermatopolymyosites, de 30 à 70 % dans la Polyarthrite Rhumatoïde, et de 100 % dans les Connectivites Mixtes. Il peut aussi être positif, mais en général à des titres faibles de l'ordre de 100 ou 200, dans diverses maladies (leucémies, cancers, infections virales..) et même chez des sujets normaux, surtout âgés. C'est donc, vis à vis du lupus systémique, un test très sensible mais peu spécifique.
La mise en évidence d'anticorps anti-ADN natif (ADNn) est le signe biologique le plus spécifique du lupus systémique. Le test de référence est le test radio-immunologique de Farr, mais d'autres sont couramment utilisés comme le test d'immunofluorescence indirecte sur le kinétoplaste de Crithidia luciliae ou des tests ELISA. Le test de Farr est positif chez 50 à 95 % des sujets atteints de lupus systémique. Plus souvent positive en phase active qu'en phase inactive de la maladie, la détection d'anticorps anti-ADNn peut se négativer sous traitement et est donc utile au suivi thérapeutique. Ces anticorps ne sont qu'exceptionnellement positifs dans d'autres maladies que le lupus systémique et constituent donc un test très spécifique et assez sensible.
Les anticorps anti-antigènes nucléaires solubles (anti-ENA, pour « extractable nuclear antigens » ou anti-ECT, pour extraits cellulaires thymiques) reconnaissent des protéines non basiques et relativement solubles dans les tampons salins. Nombre de ces protéines solubles sont liées à des petits ARN riche en uridine, présents dans le nucléoplasme, le nucléole mais aussi, pour certains, le cytoplasme. Cette catégorie regroupe principalement les anticorps anti-Sm, -RNP, -SS-A(Ro), -SS-B(La),- PMScl, -JO1 et -Scl70. La recherche de ces anticorps n'est indiquée, en règle, que lorsque le dépistage des AN par immunofluorescence s'est révélé positif. Elle fait appel à des techniques d'immunoprécipitation complétées de plus en plus souvent par des techniques immunoenzymatiques pour leur caractérisation. Les anticorps anti-Sm ne se rencontrent guère que dans le lupus systémique, dont ils sont très spécifiques, mais leur sensibilité est faible (20 à 30 %). Les anti-RNP ne sont pas spécifiques d'une maladie auto-immune mais ils sont presque toujours positifs (93 à 100 % des cas) dans les Connectivites Mixtes (CM) où leur négativité doit faire discuter la justesse du diagnostic. Ils sont en effet présents dans seulement 30 à 40 % des cas de lupus systémique et 15 à 20 % des cas de sclérodermie. Au cours du syndrome de Gougerot-Sjögren (SGS), les anticorps anti-SS-A et anti-SS-B s'observent dans 40 à 60 % des cas ; mais, dans le lupus systémique, les anticorps anti-SSA sont présents dans 25 à 35 % des cas et les anticorps anti-SS-B dans 10 % des cas ; les anticorps anti-SS-B sont donc un peu plus spécifiques du SGS, mais très peu sensibles. L'intérêt des anticorps anti-SS-A réside plutôt dans les troubles de la conduction auriculo-ventriculaire que l'on peut observer chez les nouveau-nés issus de mères anti-SS-A positives ; cependant, même dans ce cas, cet accident ne survient que dans environ une grossesse sur 20. Les anticorps anti-SS-A cytoplasmiques peuvent échapper au dépistage des AN par immunofluorescence ; il est donc légitime de les rechercher même si les AN sont négatifs, dans les cas suivants : a) suspicion de lupus néonatal ou de Bloc Auriculo-Ventriculaire (BAV) congénital, b) avortements à répétition, c) grossesse à risque de a ou b, et d) Lupus Cutané Subaigu (Nomenclature des Actes de Biologie Médicale). Les anticorps anti-PM-Scl s'observent plutôt au cours d'une forme mixte de polymyosite avec sclérodermie. Les anticorps anti-JO1 (dirigés contre une sous-unité de l'histidyl-tRNA synthétase) s'observent au cours des dermatomyosites ou polymyosites (@ 20 % des cas ; surtout ceux qui comportent une fibrose pulmonaire interstitielle diffuse). Les anticorps anti-Scl 70, dirigés contre l'ADN topoisomérase I, sont spécifiques de la sclérodermie systémique et s'observent dans 20 à 50 % des cas (ils se révèlent habituellement par une fluorescence mouchetée). Enfin, les anticorps anti-centromères sont presque spécifiques d'une forme particulière de Sclérodermie, le syndrome de CREST (qui associe des calcifications sous cutanées, un syndrome de Raynaud, une atteinte œsophagienne (esophagus en anglais d'où le E de l'acronyme), une sclérodactylie et des télangiectasies). En résumé, la recherche des AN est le test de dépistage des maladies auto-immunes systémiques, les anticorps anti-ADN natif et les anticorps anti-Sm sont spécifiques du lupus systémique et les anticorps anti-antigènes nucléaires solubles sont des marqueurs plus ou moins spécifiques d'entités nosologiques dont le diagnostic clinique est souvent malaisé, d'où leur utilité.
4 . 1 . 1 . 2 - Autres auto-anticorps non spécifiques d'organe
4. 1. 1. 2. 1 - Anticorps anti-phospholipides
Les anticorps anti-phospholipides représentent une famille très hétérogène d'aAc qui font partie intégrante de la définition du syndrome des antiphospholipides (SAPL). Ce syndrome associe des thromboses, des avortements ou des pertes fœtales répétés et des anticorps anti-phospholipides. Les principaux sont les anti-cardiolipide (ACL), les anticoagulants circulants (ACC) et les anticorps anti- bêta 2 glycoprotéine 1 (Aβ2GP1) :
Les ACL sont mis en évidence par un test de type ELISA. Ils sont fréquents dans le lupus systémique, surtout si celui-ci est compliqué d'un SAPL (dit SAPL secondaire), ainsi que dans le SAPL isolé (dit primaire). Les ACL se rencontrent aussi dans nombre de maladies infectieuses auquel cas ils ne s'accompagnent pas de thromboses, ce qui rend leur présence peu spécifique. Les ACL du lupus et du SAPL se distinguent de ceux que l'on rencontre dans les infections car ils persistent pendant plus de 3 mois à des taux relativement élevés et sont d'isotype IgG.
Les anticoagulants circulants de type lupique, ou lupus anticoagulants, ainsi nommés parce qu'ils ont initialement été mis en évidence chez des patients lupiques, sont des anticorps antiphospholipides induisant un allongement des tests de coagulation in vitro. Vis-à-vis du SAPL, ils ont à peu près la même sensibilité que les ACL, mais leur recherche en est complémentaire, car ils peuvent être seuls positifs, et réciproquement.
Les anti-β2GP1 ne se rencontrent guère dans les infections et sont donc plus spécifiques du SAPL vis-à-vis duquel ils sont cependant moins sensibles que les ACL ou les ACC.
4. 1. 1. 2. 2 - Facteurs Rhumatoïdes
Les Facteurs Rhumatoïdes (FR) sont des aAC dirigés contre le fragment constant Fc des IgG humaines et/ou animales. On les détecte et on les dose par le test au latex, dans lequel les FR de classe IgM agglutinent des particules de latex ou de polystyrène recouvertes d'IgG humaines, et par la réaction de Waaler-Rose, où ces anticorps agglutinent des hématies humaines Rh - recouvertes d'anticorps de lapin anti hématies humaines. Ces tests d'agglutination ne détectent pratiquement pas les éventuels FR d'isotype IgA ou IgG, mais sont, en pratique, suffisants pour le diagnostic de la Polyarthrite Rhumatoïde. La sensibilité et la spécificité des FR dépendent beaucoup du contexte clinique : la sensibilité est d'environ 80 % dans une polyarthrite rhumatoïde évoluant depuis quelques années mais seulement de l'ordre de 30 % dans les premiers mois de la maladie (contre 0 à 6 % chez les sujets sains) ; la spécificité est médiocre (40 %) si le contexte clinique est mal ciblé (fièvre, baisse de l'état général, arthralgies diffuses), mais bonne (80 %) s'il s'agit de polyarthrites. En effet, les FR sont fréquents dans les maladies infectieuses chroniques et non exceptionnels dans d'autres maladies auto-immunes et chez les sujets sains (0 à 6 %), surtout âgés. Des titres élevés de FR semblent être associés à un mauvais pronostic.
4. 1. 1. 2. 3 - Anticorps anti-mitochondries
Les anticorps anti-mitochondries les plus fréquemment rencontrés et les plus utiles sont révélés et dosés en routine par immunofluorescence sur des coupes de foie, de rein et d'estomac de rat ou de souris (on parle de « triple substrat », dans lesquelles les anticorps se fixent sur le cytoplasme des cellules riches en mitochondries. L'antigène cible est le plus souvent une sous-unité de 70 kD de la pyruvate deshydrogénase. Ces anticorps, à un titre supérieur ou égal à 80, sont très caractéristiques de la cirrhose biliaire primitive (CBP), avec une sensibilité de l'ordre de 90 à 99 %, ainsi qu'une très bonne spécificité, puisqu'on ne les trouve que rarement ailleurs. Il s'agit donc aAc non spécifiques d'organe qui sont cependant très spécifiques d'une maladie auto-immune limitée au foie.
4. 1. 1. 2. 4 - Anticorps anti-muscles lisses
Les anticorps anti-muscles lisses les plus intéressants en clinique sont les anticorps anti-actine qui, à un titre supérieur ou égal à 80, sont très spécifiques des hépatites chroniques auto-immunes (en particulier des hépatites auto-immunes de type 1), avec une grande sensibilité.
On les détecte par immunofluorescence sur « triple substrat », où ils se fixent sur les muscles lisses des vaisseaux sanguins, et on les caractérise par immunofluorescence sur cellules HEp2 où ils se fixent sur les filaments d'actine du cytosquelette. Les autres antigènes du cytosquelette sont la cible d'auto-anticorps de moindre intérêt car beaucoup moins spécifiques.
4. 1. 1. 2. 5 - Anticorps anti-microsomes
Les anticorps anti-microsomes de Foie et de Rein (ou anti-MFR ou encore anti-LKM pour Liver/Kidney Microsomes, ou encore anti-Reticulum Endoplasmique) sont aussi détectés par immunofluorescence sur « triple substrat ». Les plus utiles en clinique sont les anti-LKM1, dirigés contre le cytochrome P450 2D6, et rencontrés dans les hépatites auto-immunes de type 2 (titre supérieur ou égal à 80 dans 80 % des cas), mais aussi dans l'hépatite virale C (1 à 5 %) et dans les hépatites induites par l'halotane (25 %).
4. 1. 1. 2. 6 - Anticorps anti-cytoplasme des polynucléaires
Les anticorps anti-cytoplasme des polynucléaires neutrophiles (ou ANCA pour anti-Neutrophil Cytoplasm Antibodies) sont révélés par immunofluorescence indirecte sur des polynucléaires neutrophiles étalés sur une lame de verre et fixés par l'éthanol. Deux aspects prédominent : un marquage du cytoplasme définissant les cANCA (cytoplasmic ANCA) avec une fluorescence clairement cytoplasmique et granulaire ; ils correspondent le plus souvent à des anticorps anti-protéinase 3 que l'on peut caractériser et doser par ELISA et qui sont très spécifiques de la granulomatose de Wegener (sensibilité autour de 66 % et spécificité autour de 98 %). Fait intéressant, le titre des cANCA diminue quand le traitement est efficace, mais la valeur prédictive de rechute attribuée à une remontée du titre est discutée. Le deuxième aspect est moins spécifique : il s'agit, sur des polynucléaires fixés à l'éthanol (mais pas si la fixation est réalisée en formol), d'un marquage périnucléaire définissant les pANCA (perinuclear ANCA) dont la cible est, une fois sur deux environ, la myélopéroxydase.
De très nombreuses autres enzymes des polynucléaires peuvent être la cible d'auto-anticorps de type ANCA, qui peuvent également survenir de façon secondaire à une inflammation aiguë, par exemple dans le cadre d'une infection. Les anticorps anti-myéloperoxydase, et, à un moindre degré, les anticorps anti-protéinase 3, sont des marqueurs sensibles d'autres vascularites systémiques telles que la polyangéite microscopique, le syndrome de Churg et Strauss et la glomérulonéphrite sclérosante pauci-immune. Dans le syndrome de Goodpasture, les anticorps anti-membrane basale glomérulaire sont associés une fois sur deux à des ANCA.
4. 1. 1. 2. 7 – Auto-anticorps associés à des maladies auto-immunes spécifiques d'organe
Nous décrirons sous ce titre des aAc spécifiques de tissus et en rapprocherons les anti-gliadine parce qu'ils sont associés à la maladie cœliaque.
4. 1. 1. 2. 8 - Anticorps antithyroïdiens
Les anticorps anti-Thyroglobuline (TG) et les anticorps anti-thyropéroxydase (TPO) se dosent par ELISA et les anticorps anti-récepteurs de la TSH, par une technique radio-immunologique.
Les anticorps anti-TPO sont pratiquement constants dans la thyroïdite de Hashimoto (titres élevés) et dans le myxœdème primitif et très fréquents dans la maladie de Basedow (75 %). Les anticorps anti-TG sont un peu moins sensibles (85 et 50 %, respectivement) et exceptionnellement isolés ; leur recherche n'est donc indiquée que devant des anticorps anti-TPO négatifs dans un contexte où une thyroïdite auto-immune est néanmoins suspectée. Les anticorps anti-TG et anti-TPO sont positifs chez 4 à 8 % des sujets sains et plus encore chez la femme et après 60 ans. Ils sont assez souvent positifs dans d'autres maladies auto-immunes, sans que l'atteinte fonctionnelle de la glande thyroïde soit fréquente.
Les anticorps anti-récepteurs de la TSH sont de bons éléments de diagnostic de la maladie de Basedow car ils sont présents à des titres élevés dans 90 % des cas, alors que leur présence est rare dans les autres thyroïdites et exceptionnelle chez les sujets sains.
Ces auto-anticorps sont clairement pathogènes, car ils stimulent le récepteur de la TSH sur les thyréocytes, mimant l'action de l'hormone et sont associés à des taux sériques très bas de celle-ci. L'activation cellulaire qu'ils induisent est responsable de l'hyperthyroïdie observée dans la maladie de Basedow. Dans de très rares cas, les anticorps anti-récepteurs de la TSH peuvent être bloquants et responsables alors d'une hypothyroïdie associée à des taux très élevés de TSH circulante. Ces IgG traversent le placenta et peuvent entraîner une hyperthyroïdie néonatale transitoire (dans seulement 1 à 5 % des cas).
4. 1. 1. 2. 9 - Anticorps anti-peau
Ce sont de bons éléments de diagnostic dans les maladies auto-immunes bulleuses. Leur pathogénicité a souvent été démontrée et leurs cibles identifiées. Ils sont dépistés, au laboratoire, par des tests d'immunofluorescence soit directe, sur une biopsie de peau lésée, soit indirecte, sur des coupes de peau humaine ou de lèvre de lapin. Les anticorps anti-substance intercellulaire (inter-kératinocytaires) définissent le groupe des Pemphigus (pemphigus vulgaire, pemphigus superficiel et pemphigus paranéoplasique), tandis que les anticorps dirigés contre la jonction dermo-épidermique se rencontrent dans les Pemphigoïdes (pemphigoïde bulleuse, pemphigoïde cicatricielle, pemphigoïde gestationis), la dermatose à IgA linéaires et l'épidermolyse bulleuse acquise.
4. 1. 1. 2. 10 - Anticorps anti-récepteur de l'acétylcholine
Le dosage des anticorps anti-récepteur de l'acétylcholine (anti-RACh) est un dosage radio-immunologique. La présence des anti-RACh est très spécifique de la myasthénie. Sa sensibilité est moyenne dans la myasthénie oculaire (50 à 60 %) et excellente dans la myasthénie généralisée (80 à 95 %). La corrélation des titres avec l'activité de la maladie rend ce test utile au suivi thérapeutique. Ces anticorps sont pathogènes, comme en témoignent, entre autres, les syndromes myasthéniques transitoires observés chez 10 à 20 % des nouveau-nés de mère myasthénique.
4. 1. 1. 2. 11 - Anticorps anti-estomac
Les anticorps anti-cellules pariétales gastriques et anti-Facteur Intrinsèque sont associés à la gastrite atrophique de type A et à l'anémie de Biermer qui paraît en découler par défaut d'absorption de la vitamine B12. Les anticorps anti-cellules pariétales sont recherchés par immunofluorescence indirecte sur coupes d'estomac de rat ou de souris ; ils reconnaissent l'ATPase H+/K+ dépendante (ou pompe à protons) ; Ils sont très fréquents dans l'anémie de Biermer (70à 100 %), un peu moins dans la gastrite atrophique (20 à 50 %) et surtout peu spécifiques puisque on en trouve fréquemment dans les endocrinopathies auto-immunes, notamment thyroïdites et DID, dans les cancers gastriques (20 à 40 %) et même chez les sujets sains, surtout âgés (5 à 15 %). Les anticorps anti-Facteur Intrinsèque sont, par contre, des marqueurs très spécifiques de l'anémie de Biermer, mais leur sensibilité est plus faible (50 à 70 % des patients).
4. 1. 1. 2. 12 - Anticorps anti-membrane basale glomérulaire
Les anticorps anti-membrane basale glomérulaire (MBG) sont, au mieux, détectés par immunofluorescence directe sur la ponction biopsie rénale des patients atteints de syndrome de Goodpasture ; un dépôt linéaire d'IgG est très spécifique de cette maladie. Ces anticorps peuvent aussi être recherchés par immunofluorescence indirecte sur coupes de reins humains ou simiens ainsi que par ELISA. Ces anticorps reconnaissent aussi le même épitope sur la membrane alvéolaire pulmonaire, ce qui explique l'habituelle atteinte pulmonaire de ce syndrome.
4. 1. 1. 2. 13 - Anticorps antisystème nerveux
Les anticorps anti-MAG (myelin associated glycoprotein) sont des IgM monoclonales associées à des neuropathies sensitives ou sensitivomotrices démyélinisantes. On ne les recherche donc que dans le cadre de neuropathies associées à une IgM monoclonale sérique. Les anticorps anti-gangliosides sont dirigés contre des glycolipides ubiquitaires dont le Système Nerveux est particulièrement riche. Les plus fréquemment observés en clinique sont les anticorps anti-GM1. Des IgM (polyclonales) anti-GM1 peuvent être détectées chez 30 à 50 % des patients atteints de Neuropathies Motrices Multifocales avec Bloc de Conduction. Ces auto-anticorps ont un grand intérêt pronostic car leur présence prédit une sensibilité de la neuropathie au traitement par des immunoglobulines intraveineuses.
4. 1. 1. 2. 14 - Auto-anticorps associés au diabète
Parmi les nombreux auto-anticorps associés au Diabète InsulinoDépendant auto-immun (DID), quatre méritent une mention spéciale : les anticorps dirigés contre les cellules b des îlots de Langerhans (ou ICA pour islet cell antibody, objectivés par immunofluorescence indirecte sur coupes de pancréas, les anticorps anti-Glutamic Acid Decarboxylase (ou-anti-GAD), les anticorps anti-IA-2 dirigés contre une protein-tyrosine-phosphatase des îlots de Langerhans et les anticorps anti-insuline.
La recherche des ICA est la technique originale ; elle détecte les anticorps anti-GAD et les anticorps anti-IA-2, mais pas les anticorps anti-insuline qui peuvent être les premiers à apparaître. La mise en évidence d'anticorps anti-insuline n'a aucune valeur si le patient a reçu un traitement par insuline. Les anticorps anti-GAD (présents dans 80 % des cas au début de la maladie), anti-IA-2 et anti-insuline (présents dans 50 % des cas au début de la maladie) sont plus fiables et intéressent le clinicien à deux titres : la présence d'au moins un de ces trois auto-anticorps affirme l'étiologie auto-immune d'un diabète et, chez les sujets à risque (enfant ou germain d'un patient atteint de DID ayant un des génotypes HLA de susceptibilité-cf.chap 3.3), a une valeur prédictive du développement d'un DID d'autant plus élevée qu'elle est associée à un ou deux autres autoanticorps. Malheureusement, à ce jour, cette prédiction ne peut pas être suivie d'une thérapeutique préventive efficace. Ces anticorps ne semblent pas avoir d'intérêt dans le suivi thérapeutique : ils tendent spontanément à disparaître au cours de l'évolution de la maladie, lorsque les îlots de Langerhans sont totalement détruits et qu'il n'y a plus d'auto-antigènes. Seuls les anticorps anti-GAD peuvent persister car l'enzyme qu'ils reconnaissent est présente dans d'autres tissus que le pancréas.
4. 1. 1. 2. 15 - Auto-anticorps associés à la maladie cœliaque
La maladie cœliaque est une maladie complexe. D'une part, c'est une intolérance au gluten, caractérisée par la présence d'anticorps anti-gliadine (qui ne sont pas des aAc), d'isotype IgG et surtout IgA. D'autre part, c'est une maladie auto-immune avec des réponses IgG et surtout IgA contre l'endomysium des fibres musculaires lisses et la réticuline. Le principal autoantigène reconnu par les anticorps anti-endomysium est la transglutaminase tissulaire (tTG). Les IgA anti-endomysium et les IgA anti-tTG sont les aAc les plus sensibles (85 à 100 %) et les plus spécifiques (95 à100 %) vis-à-vis de la maladie cœliaque et de la dermatite herpétiforme qui en est probablement la forme cutanée. Les anticorps anti-endomysium se recherchent par immunofluorescence indirecte sur coupes d'œsophage de singe qui est actuellement la meilleure technique validée. Cependant elle n'est pas toujours facile à interpréter, relativement lourde à mettre en œuvre et semi-quantitative. La recherche des IgA anti-transglutaminase en ELISA semble constituer une alternative intéressante, notamment pour le dépistage des formes frustes, dépistage nécessaire car il justifie la mise en place d'un régime sans gluten. Les anticorps anti-gliadine, si l'on dose les IgG et les IgA, ont une sensibilité à peu près équivalente aux IgA anti-endomysium, mais une spécificité insuffisante : on en rencontre dans la Polyarthrite Rhumatoïde, des hépatopathies, et certaines néphropathies. Ils semblent cependant intéressants, d'une part chez les enfants de moins de 2 ans chez lesquels les IgA anti-gliadine pourraient apparaître avant les IgA anti-endomysium et, d'autre part, en cas de déficit en IgA où seules des IgG anti-gliadine peuvent être présentes. Les anticorps anti-réticuline se sont avérés moins sensibles et moins spécifiques (mais ce point est encore discuté) que les anticorps anti-endomysium. Enfin, le titre des anticorps anti-gliadine et celui des anticorps anti-endomysium diminue en quelques mois au cours d'un régime sans gluten bien suivi, et augmente à nouveau en cas d'écarts de régime, ce qui fait de ces anticorps de bons outils de suivi du traitement.
4/8