- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Introduction
- 2 - Mécanismes fondamentaux
- 3 - Aspects épidémiologiques
-
4 - Aspects diagnostiques
- 4.1 - Diagnostic biologique
-
4.2 - Diagnostic clinique
-
4
.
2
.
1 - Les maladies auto-immunes systémiques ou non spécifiques d'organe
- 4 . 2 . 1 . 1 - Lupus Érythémateux Aigu Disséminé (LEAD) ou Systémique (LES)
- 4 . 2 . 1 . 2 - Sclérodermie
- 4 . 2 . 1 . 3 - Polymyosite et dermatopolymyosite
- 4 . 2 . 1 . 4 - Syndrome de Gougerot-Sjögren
- 4 . 2 . 1 . 5 - Syndrome de Sharp ou connectivité mixte
- 4 . 2 . 1 . 6 - Remarque sur les vascularites avec auto-anticorps
- 4 . 2 . 2 - Maladies auto-immunes spécifiques d'organe
-
4
.
2
.
1 - Les maladies auto-immunes systémiques ou non spécifiques d'organe
- 5 - Principes du traitement des maladies auto-immunes
- 6 - Surveillance au long cours d'une maladie auto-immune systémique
-
Version PDF

-
Contenu
- Evaluations
- Annexes
2 - Mécanismes fondamentaux
2 . 1 - Tolérance du soi
La tolérance est un état de non-réponse immunitaire à un antigène, spécifique de cet antigène. C'est un phénomène actif, induit par un contact préalable avec l'antigène. Normalement, un organisme est tolérant à ses propres constituants : c'est la tolérance du soi ou auto-tolérance. Celle-ci implique les lymphocytes T et, à un moindre degré, les lymphocytes B.
Mécanismes de la tolérance du soi
Tolérance T :
Tolérance B :
|
2 . 1 . 1 - La tolérance des lymphocytes T
La tolérance des lymphocytes T est induite essentiellement dans le thymus par délétion clonale, pendant la maturation des clones T autoréactifs (c’est-à-dire dont les récepteurs, les TCR, peuvent reconnaître un épitope du soi).
Le répertoire T est en effet façonné par le double jeu des sélections positive, puis négative. Sans revenir sur la génération aléatoire de la diversité des TCR, il faut se rappeler que, dans un premier temps, dans le cortex thymique, les lymphocytes T ayant acquis des TCR fonctionnels vont être sauvés d'une mort programmée apoptotique si ces récepteurs reconnaissent avec une avidité suffisante les molécules du CMH exprimées sur les cellules épithéliales thymiques ; c'est la sélection positive ; elle concerne des cellules T CD4+/CD8+ qui deviennent alors des T CD4+ ou des T CD8+ selon qu'elles ont reconnu une molécule de classe II ou de classe I, respectivement. Dans un second temps, les cellules CD4+ ou CD8+ qui reconnaissent, semble-t-il avec une assez forte avidité, un épitope du soi présenté à la jonction cortico-médullaire par des cellules dendritiques ou des macrophages, en association avec une molécule du CMH, sont éliminées par apoptose : c'est la sélection négative ou délétion clonale.
Ainsi, la grande majorité des clones T autoréactifs sont éliminés. Cependant, certains d'entre eux échappent à la délétion clonale thymique, soit parce que l'autoantigène correspondant n'est pas exprimé dans le thymus (autoantigènes séquestrés), soit parce que l'épitope en question n'est pas reconnu avec une avidité suffisante pour entraîner la délétion du clone.
2 . 1 . 2 - Trois mécanismes additionnels
Trois mécanismes additionnels contribuent à l'autotolérance en contrôlant les clones T ayant échappé à la délétion clonale thymique.
- L'ignorance, ou indifférence des lymphocytes T, concerne les épitopes présentés par les cellules des tissus qui n'expriment pas de molécules du CMH : les lymphocytes T peuvent entrer en contact avec eux sans les « voir », puisqu'ils ne peuvent reconnaître qu'un complexe épitope-CMH. C'est par exemple le cas des hématies et du tissu adipeux.
- L'anergie est un état de non-réponse spécifique induit dans un lymphocyte T par une stimulation antigénique non accompagnée des signaux de costimulation délivrés par certaines molécules membranaires des cellules présentatrices d'antigènes (CD80, CD86). Ces molécules sont exprimées essentiellement par des cellules présentatrices activées ; en leur absence, le lymphocyte T n'est pas tué, mais fonctionnellement inactivé, anergisé.
- Le troisième mécanisme est le contrôle des clones T autoréactifs par des lymphocytes T suppresseurs.
2 . 1 . 3 - La délétion et l'anergie des lymphocytes B
La délétion et l'anergie des lymphocytes B peuvent survenir au cours de leur maturation dans la moelle osseuse ou plus tard, dans les organes lymphoïdes secondaires, ganglions lymphatiques, rate, tissu lymphoïde associé aux muqueuses.
La tolérance des lymphocytes B est moins efficace que celle des lymphocytes T. Cependant, la pleine activation des lymphocytes B nécessite, dans la majorité des cas, la coopération de cellules T. Donc, en l'absence de lymphocytes T autoréactifs fonctionnels, les lymphocytes B autoréactifs seront peu activés et ne sécréteront, au mieux, que des aAc dits naturels, d'isotype IgM, de faible titre, polyspécifiques et non pathogènes.
Autoanticorps naturels, autoanticorps pathologiques
| Autoanticorps naturels | Autoanticorps pathologiques | |
| Spécificité | polyspécifiques | monospécifiques |
| Affinité | faible | forte |
| Isotypes | Ig M | Ig G > Ig M |
| Idiotypes | publiques | privés |
| Gènes VH | germinaux | mutés |
2 . 1 . 4 - L'autotolérance
Au total, l'autotolérance repose essentiellement sur la tolérance des lymphocytes T dont on peut penser qu'elle pourra être « court-circuitée » de différentes manières, fournissant alors aux lymphocytes B le 2° signal nécessaire à la production de grandes quantités d'aAc potentiellement pathogènes.
2 . 2 - Mécanismes de l'auto-immunisation
Les mécanismes conduisant à une production d'aAc pathogènes par une rupture durable de l'autotolérance sont mal connus. La contribution indiscutable de facteurs génétiques et de facteurs environnementaux ainsi que les résultats obtenus dans les modèles expérimentaux de maladies auto-immunes montrent que cette rupture est multifactorielle. Les principaux mécanismes qui pourraient être impliqués, non mutuellement exclusifs, sont les suivants :
- Court-circuit des lymphocytes T auxiliaires tolérants : un antigène exogène peut présenter des similitudes de structure avec un antigène du soi de telle sorte que la même molécule portera des épitopes du non-soi et un épitope du soi. Ainsi, des lymphocytes T reconnaissant un épitope étranger, non toléré, pourront coopérer avec des lymphocytes B dirigés contre l'épitope commun au soi et à l'antigène exogène, permettant ainsi aux lymphocytes B de produire de grandes quantités d'aAc. Ce mimétisme moléculaire pourrait rendre compte du rôle des infections dans l'auto-immunité. De façon analogue, la modification physique (U V, chaleur) ou chimique (médicaments hapténiques) d'un auto-antigène peut déclencher une auto-immunisation.
- L'expression anormale des molécules HLA de classe II à la surface de cellules, qui, naturellement, n'en expriment pas, peut permettre à des lymphocytes T ayant échappé à la délétion et à l'anergie de reconnaître un autoantigène. Des infections, en particulier virales, peuvent induire une telle expression. Cela n'est pas suffisant expérimentalement pour induire une maladie auto-immune, mais dans la mesure où l'auto-immunisation est multifactorielle, ce mécanisme peut être un des éléments impliqués. Un défaut de contrôle par des cellules T suppressives peut aussi contribuer à l'auto-immunisation, comme le montrent certains modèles animaux et comme le suggèrent les déficits en fonctions T-suppressives constatés dans nombre de maladies auto-immunes.
- Une hyperactivité des lymphocytes T et/ou B est aussi évoquée et constatée dans certaines maladies auto-immunes, en particulier systémiques. Elle peut être due à une infection des lymphocytes B par le virus d'Epstein Barr, à une activation polyclonale par un super antigène d'origine infectieuse, à une réaction du greffon contre l'hôte chez un receveur de moelle osseuse, à un traitement par l'IL2 ou encore à un défaut d'apoptose. On peut, là aussi, souligner le caractère multifactoriel de l'auto-immunité-maladie, car si une infection EBV s'accompagne en effet de la production d'aAc, celle-ci est transitoire et ne conduit qu'exceptionnellement à une maladie auto-immune.
- Un défaut de contrôle par le réseau idiotypique est aussi suggéré par des modèles animaux et par l'efficacité du traitement de certaines auto-immunisations par les immunoglobulines intraveineuses dont on a pu montrer que les anticorps anti-idiotypes étaient parfois le principe actif.
- Enfin, le système immunitaire ne développe pas de tolérance vis-à-vis des autoantigènes séquestrés de l'œil, des testicules ou du cerveau. Une lésion traumatique de ces tissus peut conduire à une auto-immunisation.
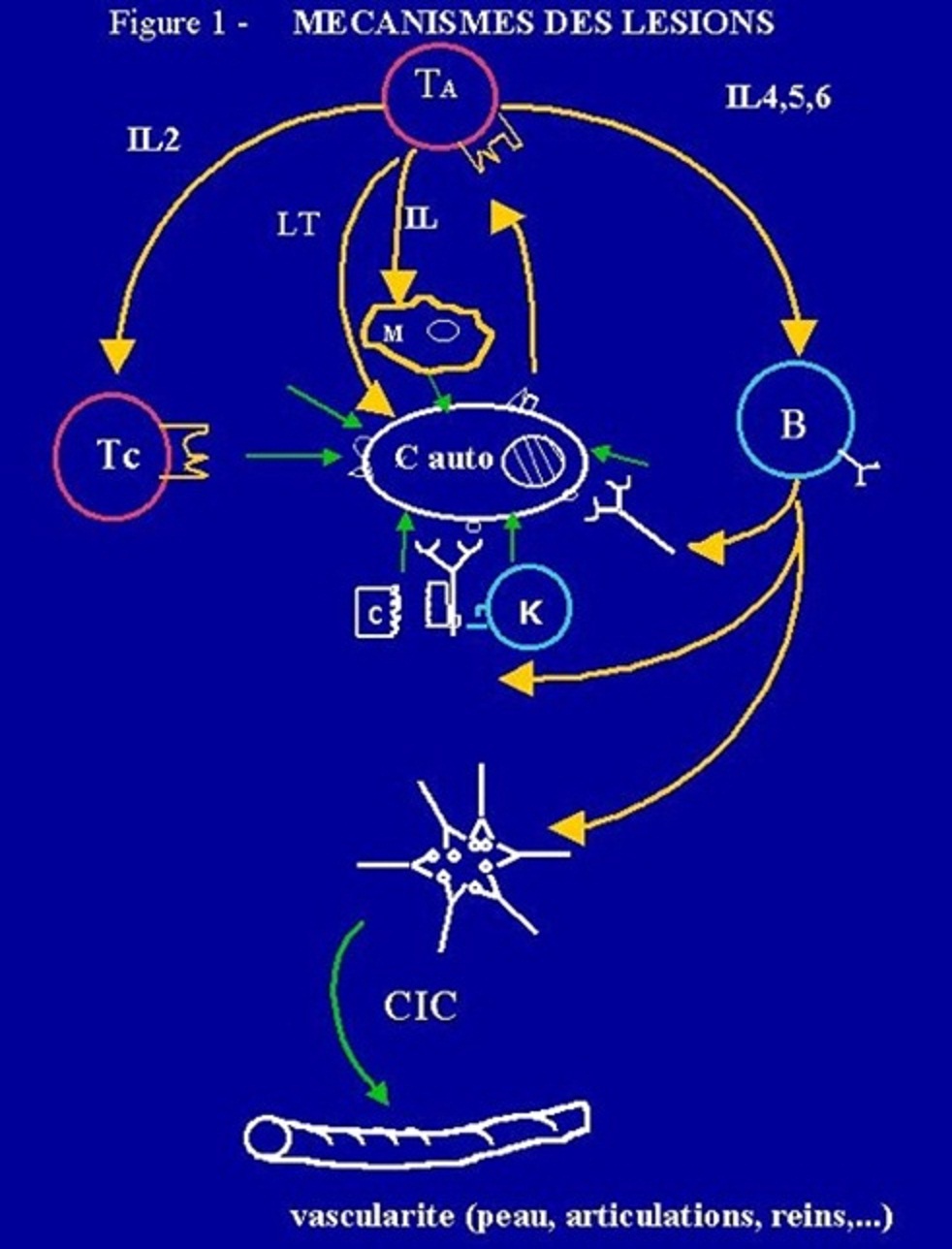
2 . 3 - Mécanismes des lésions
2 . 3 . 1 - Maladies par auto-anticorps ou avec auto-anticorps ?
Les aAc sont, à ce jour, les principaux marqueurs immunologiques des maladies auto-immunes ; cependant, pour certains d'entre eux, la question se pose de savoir s'ils sont la cause ou la conséquence des lésions observées. C'est pourquoi il est plus correct de définir les maladies auto-immunes comme des maladies avec aAc (avec des taux significatifs de certains aAc) plutôt que comme des maladies par aAc. La meilleure preuve de leur pathogénicité est donnée par l'efficacité du transfert de la maladie, ou au moins des symptômes, par le sérum d'un animal atteint à un animal sain. Chez l'homme, ce type de preuve est apporté par la constatation du transfert transitoire de la maladie ou de ses symptômes par les aAc IgG de la mère au fœtus (lupus néonatal, hyperthyroïdie néonatale…).
2 . 3 . 2 - Rôle des auto-anticorps
Mécanismes des lésions
Les auto-Ac peuvent être responsables des lésions de plusieurs façons :
- en fixant et en activant le système du complément sur la membrane de la cellule portant l'antigène cible, provoquant la lyse de cette cellule (anémie hémolytique auto-immune) ;
- en opsonisant la cellule ou la structure portant l'autoantigène correspondant, provoquant ainsi sa destruction par les macrophages (purpura thrombopénique idiopathique) ;
- en modifiant le signal transmis par un récepteur cellulaire, soit dans le sens de l'activation, comme les anti-récepteurs de la TSH dans la maladie de Basedow, soit dans celui de l'inhibition, comme les anti-récepteurs de l'acétylcholine dans la myasthénie qui participent avec d'autres mécanismes au blocage de la plaque motrice ;
- en provoquant la formation durable de Complexes Immuns Circulants (CIC) qui pourront se déposer dans les vaisseaux et entraîner des lésions de vascularite dans divers organes, sans rapport avec la spécificité tissulaire des auto-anticorps (lupus érythémateux systémique) ;
- en formant in situ des complexes immuns générant une réponse inflammatoire et une altération de l'organe cible (pemphigus, pemphigoïde, syndrome de Goodpasture).
2 . 3 . 3 - Rôle des lymphocytes T
Des lymphocytes T peuvent aussi, et ce de manière conjointe ou isolée, être directement responsables des lésions de certaines maladies auto-immunes. Ceci a été démontré dans des maladies auto-immunes expérimentales comme l'Encéphalomyélite Auto-immune Expérimentale (EAE) et le Diabète InsulinoDépendant (DID) de la souris NOD, par exemple, où la maladie n'est pas transmissible par le sérum, mais seulement par les lymphocytes T. C'est probable, mais moins facile à prouver, dans certaines maladies auto-immunes humaines comme la Polyarthrite Rhumatoïde (PR) et le DID.
2/8