- Pré-requis et Objectifs
- Cours
- Annexes
4 - Décrire les principes de la prise en charge au long cours
Indépendamment du traitement de la maladie causale, la prise en charge au long cours des patients cirrhotiques a comme principaux objectifs :
– de prévenir les hémorragies digestives en rapport avec l’hypertension portale ou leur récidive ;
– de contrôler l’ascite et les oedèmes ;
– de prévenir l’infection du liquide d’ascite chez les malades à risque ;
– de prévenir les épisodes d’encéphalopathie ;
– de réaliser un dépistage systématique du carcinome hépatocellulaire.
4 . 1 - Hypertension portale : prévention des hémorragies digestives
1. Prévention primaire
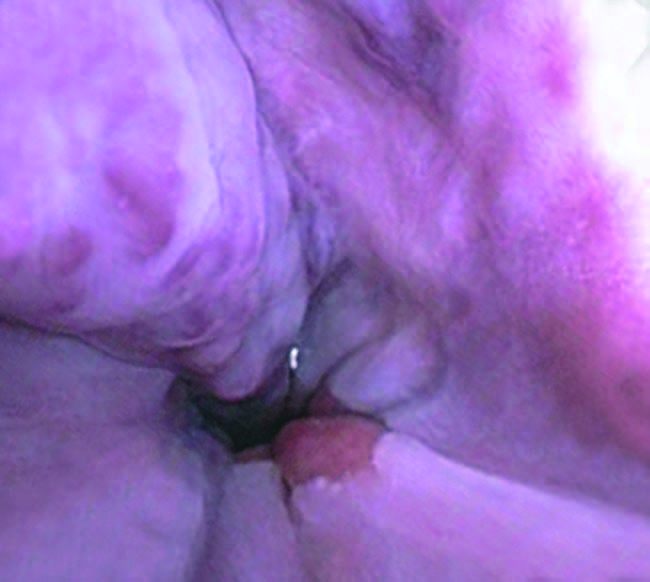
Une endoscopie digestive haute doit systématiquement être réalisée lors de la prise en charge initiale des cirrhotiques. Les principaux facteurs prédictifs d’une hémorragie par rupture de varices oesophagiennes sont la taille des varices, la présence de signes rouges (fig. 19.5) et la sévérité de l’insuffisance hépatique.
Chez les malades qui initialement n’ont pas de varices oesophagiennes, l’endoscopie doit être répétée au terme de 3 ans. Chez les malades qui ont des varices oesophagiennes de grade I (de petite taille), l’endoscopie doit être répétée au terme de 1 an. Chez les malades qui ont des varices oesophagiennes de grade II, III ou IV (moyennes ou larges), il n’est pas utile de répéter les endoscopies.
Une simple surveillance peut être proposée aux malades qui n’ont pas de varices oesophagiennes ou qui ont des varices oesophagiennes de grade I. Un traitement préventif des hémorragies digestives est justifié chez les malades qui ont des varices oesophagiennes de grade II à IV.
Le traitement de première intention repose sur l’administration de bêtabloquants non sélectifs (propranolol, 80 à 160 mg/j ou nadolol, 80 mg/j). La réduction du risque hémorragie est liée à une réduction du débit cardiaque, du débit splanchnique et de la pression portale. L’objectif est d’obtenir une réduction de 25 % de la fréquence cardiaque ou une diminution de la fréquence cardiaque au-dessous de 55 battements/min. Seuls 15 à 20 % des malades ne peuvent pas être traités en raison de contre-indications (telles que des troubles de la conduction) ou d’intolérance.
Le traitement de seconde intention repose sur l’éradication endoscopique des varices par des ligatures élastiques. L’éradication peut être obtenue en 4 à 6 séances. L’efficacité est comparable à celle des bêta-bloquants. Toutefois, ce traitement est plus complexe et plus contraignant. Les ligatures élastiques peuvent être utilisées chez les malades qui ont une mauvaise observance aux bêta-bloquants.
Fig. 19.5. Présence de signes rouges sur des varices oesophagiennes (zones de coloration rouge, sans relief, siégeant à la surface des cordons variqueux)
2. Prévention des récidives chez les malades qui ont déjà eu une hémorragie (prévention secondaire)
La prévention des récidives varie selon que les malades recevaient ou ne recevaient pas de bêta-bloquants.
Chez les malades qui ne recevaient pas de prophylaxie, les bêta-bloquants peuvent être introduits pour prévenir les récidives. Leur efficacité dans cette indication est démontrée.
Chez les malades qui ont eu une hémorragie malgré la prise de bêta-bloquants comme chez ceux qui avaient une mauvaise observance, il est préférable d’avoir recours aux ligatures endoscopiques, jusqu’à l’éradication complète des varices. Lorsque les varices ont été éradiquées, des examens endoscopiques de contrôle doivent être réalisés (tous les 6 mois à 1 an) car les varices ont tendance à se reconstituer. Il n’y a pas de bénéfice à associer les ligatures endoscopiques aux bêta-bloquants.
L’efficacité du TIPS est supérieure à celle des bêta-bloquants et des ligatures endoscopiques pour prévenir les récidives hémorragiques. Toutefois, la morbidité du TIPS est supérieure. Le TIPS ne doit donc être envisagé qu’en cas d’échec des bêta-bloquants et des ligatures endoscopiques.
Les anastomoses porto-systémiques chirurgicales ont été presque totalement abandonnées en raison d’une morbidité et d’une mortalité supérieures à celles du TIPS.
4 . 2 - Contrôle de l’ascite
Le traitement de l’ascite a été détaillé aux chapitres précédents. Chez les patients qui ont eu au moins une poussée d’ascite, il est recommandé de maintenir un régime pauvre en sodium. Lorsque l’ascite a été contrôlée, il est préférable d’arrêter les diurétiques. Chez certains malades, l’ascite ne réapparaît pas à l’arrêt des diurétiques. Chez d’autres, l’ascite réapparaît. L’objectif est alors de déterminer la dose minimale de diurétiques qui permet le contrôle de l’ascite. Un traitement diurétique au long cours nécessite une surveillance régulière de la natrémie, de la kaliémie et de la créatininémie (toutes les 2 à 4 semaines).
Les malades qui ont une concentration de protides inférieure à 10 g/L dans l’ascite ont un risque significativement plus élevé de développer une infection du liquide d’ascite. L’intérêt d’une antibioprophylaxie (norfloxacine) systématique au long cours dans cette population est discuté. L’antibioprophylaxie au long cours favorise la sélection de bactéries résistantes. De même, l’intérêt d’une antibioprophylaxie par norfloxacine pendant plusieurs mois après un épisode d’infection du liquide d’ascite est controversé. L’antibioprophylaxie a un intérêt lorsqu’un traitement radical (transplantation) est envisagé. En l’absence de cette perspective de traitement radical, son intérêt est limité.
4 . 3 - Prévention de l’encéphalopathie
Le traitement de l’encéphalopathie est essentiellement préventif. Les malades doivent être informés du risque d’encéphalopathie après la prise de médicaments sédatifs (anxiolytiques et hypnotiques en particulier), même aux doses thérapeutiques.
L’utilisation de ces médicaments est fortement déconseillée en cas de cirrhose. Les malades traités pour un diabète doivent également être informés du risque d’encéphalopathie en cas d’hypoglycémie. Le régime pauvre en protides doit être proscrit en raison de son inefficacité et du risque de favoriser une dénutrition.
4 . 4 - Dépistage du carcinome hépatocellulaire
L’incidence annuelle du carcinome hépatocellulaire (CHC) au cours de la cirrhose est de l’ordre de 1 à 5 %. Le CHC reste habituellement asymptomatique jusqu’à ce que la taille de la tumeur soit supérieure à 8-10 cm. Un dépistage systématique est donc indispensable ; l’objectif étant de diagnostiquer le CHC à un stade précoce.
Le dépistage repose sur l’échographie et le dosage de l’alphafoetoprotéine (AFP). Ces examens doivent être répétés au moins tous les 6 mois.
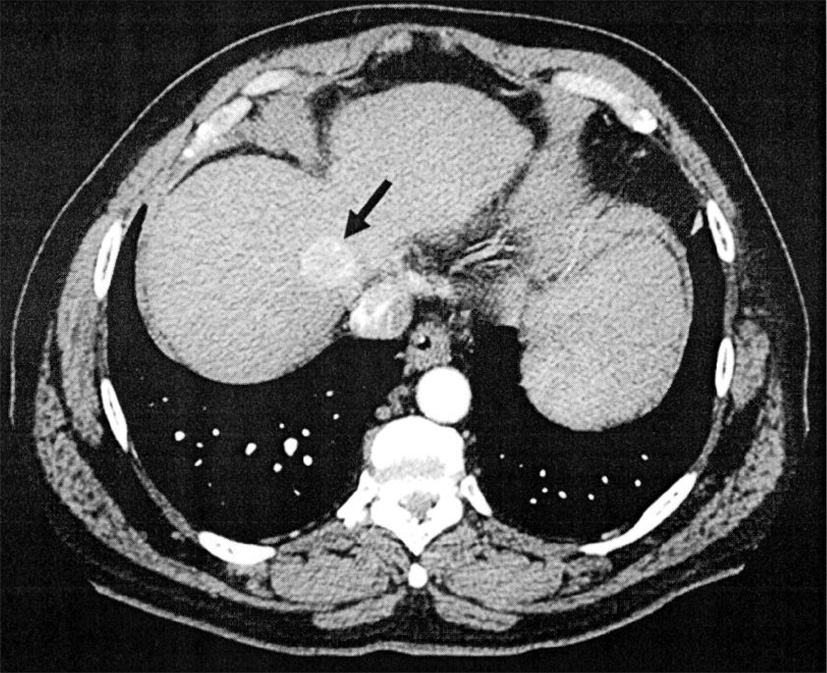
L’échographie permet de dépister des nodules de moins de 1 cm de diamètre. Le CHC se traduit habituellement par une zone hypoéchogène. Toutefois, toutes les lésions hypoéchogènes ne correspondent pas à un CHC (il peut s’agir en particulier de nodules de régénération bénins) et tous les CHC ne sont pas hypoéchogènes. En cas de doute, l’échographie doit donc être complétée par un examen tomodensitométrique (fig. 19.6) et/ou une résonance magnétique nucléaire. Les caractéristiques du CHC en imagerie sont son aspect hypervasculaire au temps artériel et hypovasculaire au temps veineux (portal) par rapport au parenchyme hépatique adjacent. Lorsque le comportement du ou des nodules en imagerie n’est pas caractéristique, une biopsie écho-guidée peut être nécessaire (voir chapitre 11).
Fig. 19.6. Carcinome hépatocellulaire en tomodensitométrie (flèche) caractérisé par une prise de contraste au temps artériel
Une concentration d’AFP supérieure à 500 ng/mL est presque spécifique du CHC chez les sujets cirrhotiques. Il est rare que des patients aient une élévation de l’AFP supérieure à 500 ng/mL en l’absence de nodule visible en échographie.
4 . 5 - Utilisation de scores pronostiques
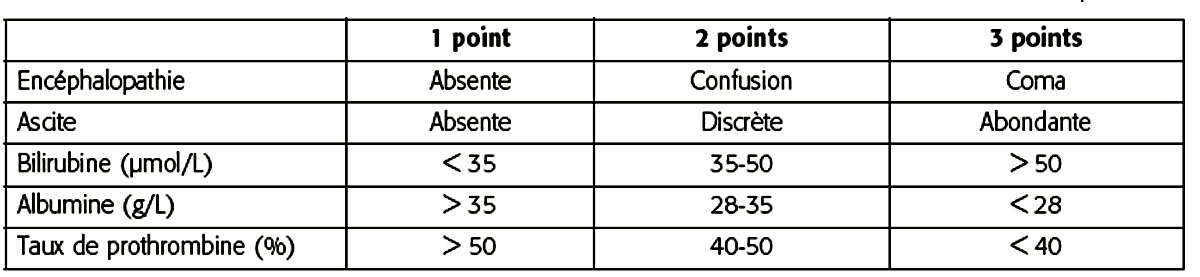
Deux scores sont couramment utilisés pour évaluer le pronostic au cours de l’évolution de la cirrhose : le score de Child-Pugh et le score MELD, d’introduction plus récente. Le score de Child-Pugh est résumé dans le tableau 19.II. Les 3 variables prises en compte pour le calcul du score MELD sont la bilirubine, l’INR et la créatininémie. À l’inverse du score de Child-Pugh, le score MELD est un score continu variant de 6 à 40 points. La transplantation hépatique n’est envisagée que chez les malades dont le score excède = 11-15 (à moins qu’il existe un CHC).
(7)Surveillance des malades atteints de cirrhose non compliquée et prévention primaire des complications.
(8) Prise en charge des complications chez les malades atteints de cirrhose.
Tableau 19.II. Score de Child-Pugh
5/5