- Pré-requis et Objectifs
-
Cours
- Contenu
- Points essentiels
-
Version PDF

- Annexes
1 . 3 - Confirmation du diagnostic
La confirmation diagnostique de maladie de Crohn doit passer par la réalisation d’une endoscopie œso-gastro-duodénale et d’une coloscopie (avec si possible iléoscopie rétrograde) avec biopsies étagées, même en territoire apparemment sain. Les granulomes ou les signes histologiques d’inflammation chronique peuvent être présents dans une muqueuse en apparence saine.
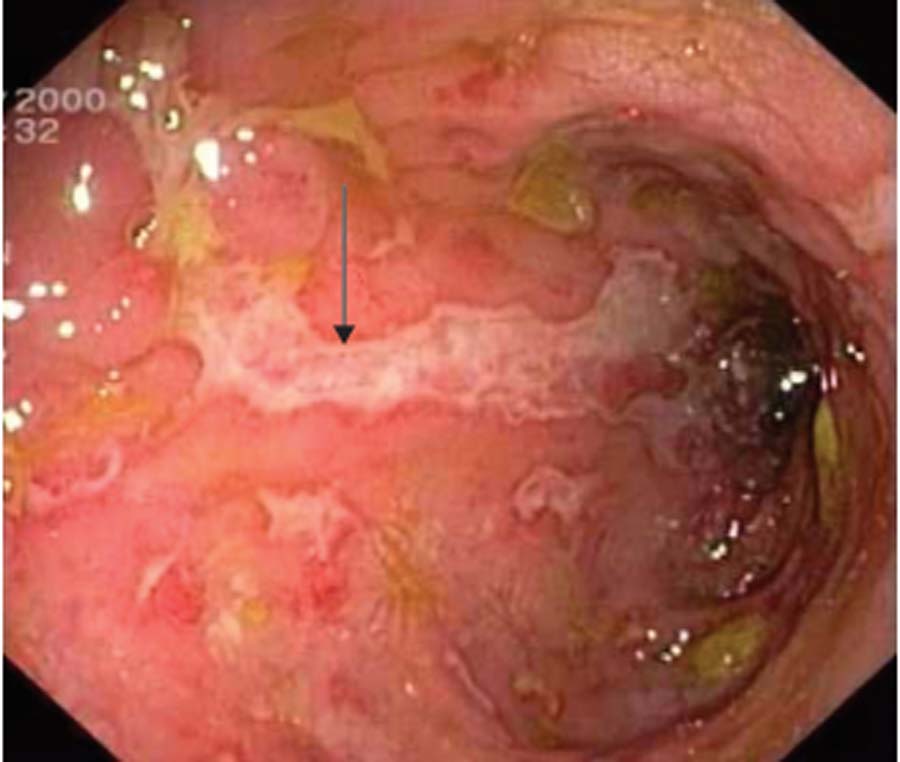
Les lésions endoscopiques les plus évocatrices de maladie de Crohn, habituellement séparées par des intervalles de muqueuse saine en apparence, sont les ulcérations aphtoïdes (comme des aphtes de la bouche), les ulcérations en carte de géographie (fig. 8.2) et en rails. Ces lésions ne sont pas spécifiques, car elles peuvent se voir au cours de certaines colites bactériennes.
Les ulcérations profondes peuvent se voir au cours des colites infectieuses, de la maladie de Crohn et de la rectocolite hémorragique.
Un examen proctologique, à la recherche de lésions caractéristiques de maladie de Crohn (fissures latérales, ulcérations endo-anales, pseudo-marisques ulcérées, abcès et/ou fistules complexes) doit être fait : il est parfois utile au diagnostic de départ et il est toujours nécessaire à l’état des lieux lésionnel initial.
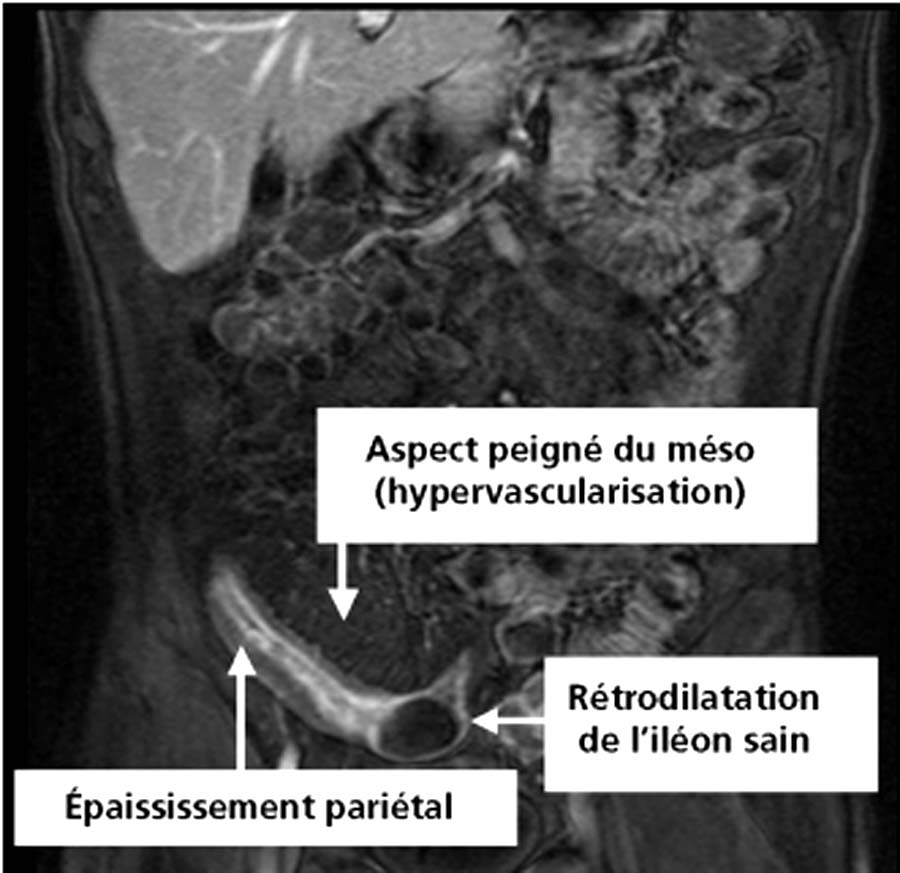
Si l’on suspecte une atteinte de l’intestin grêle, celle-ci doit être cherchée, pour les segments inaccessibles à l’endoscopie conventionnelle par un transit baryté du grêle et/ou une entéro-IRM. Un examen par vidéocapsule ou une entéroscopie double ballon (dont l’avantage, par rapport à l’examen par vidéocapsule est de pouvoir réaliser des biopsies) sont rarement indiqués. Les anomalies radiologiques de la maladie de Crohn sont segmentaires (alternance de zones d’intestin sain et malade) et asymétriques par rapport à l’axe de l’intestin ; elles résultent de l’association d’une rigidité et/ou d’un épaississement des parois, de rétrécissements, d’ulcérations et d’un aspect nodulaire de la muqueuse. Il peut en résulter des aspects de pavage, des images de fissures et de fistules ainsi que des sténoses (fig. 8.3).
Fig. 8.2. Ulcération en carte de géographie (flèche) au cours d’une maladie de Crohn.
Les lésions de maladie de Crohn sont habituellement segmentaires, asymétriques, et les localisations séparées par des zones saines. À l’examen microscopique des biopsies ou d’une pièce opératoire, on peut mettre en évidence des pertes de substance muqueuse, des distorsions glandulaires, une infiltration lympho-plasmocytaire du chorion muqueux, voire transmurale (c’est-à-dire intéressant toute la paroi intestinale), souvent sous forme de nodules lymphoïdes.
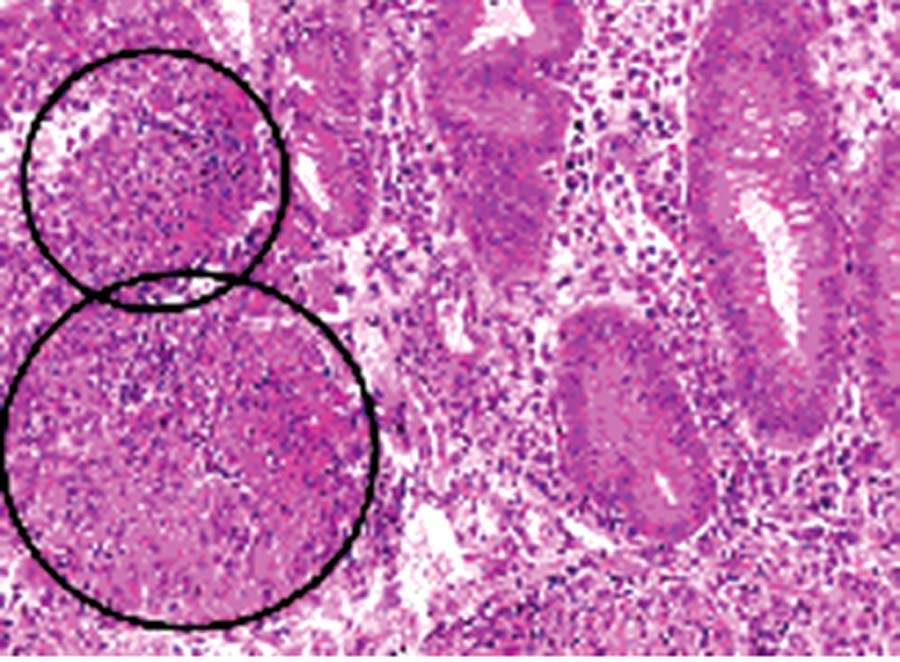
Il existe dans 20 à 30 % des cas des granulomes épithélioïdes et gigantocellulaires (fig. 8.4) qui sont très évocateurs de l’affection. Les fissures en zigzag, les fistules et les abcès sont fréquents. Le quadrillage par des fissures d’une muqueuse boursouflée lui donne un aspect pavé. La paroi intestinale est épaissie (car l’inflammation peut affecter toute la paroi) et les mésos sont le siège d’une scléro-lipomatose.
En résumé, l’association du contexte clinique et biologique et de certains aspects radiologiques caractéristiques de l’intestin grêle apporte parfois une quasi-certitude diagnostique de maladie de Crohn. Le plus souvent, les éléments histologiques (biopsies réalisées pendant une endoscopie œso-gastro-duodénale ou une iléocoloscopie, éventuelles pièces opératoires) apportent la confirmation définitive du diagnostic. Les arguments les plus forts du diagnostic positif de maladie de Crohn sont le caractère discontinu et multisegmentaire des lésions, les fissures transmurales histologiques et le granulome épithélioïde et gigantocellulaire quand il est présent.
Fig. 8.4. Granulomes épithélioïdes et gigantocellu- aires au cours de la maladie de Crohn. Les granulomes sont des groupements de cellules contenant en proportions variables des cellules épi- hélioïdes des cellules géantes et des lymphocytes.
1 . 4 - Diagnostic différentiel
Il est envisagé en fonction des situations cliniques.
1 . 4 . 1 - Diarrhée aiguë révélant une iléo-colite
Une maladie de Crohn débute dans 10 à 20 % des cas de façon aiguë, du jour au lendemain, comme une gastro-entérite. Les gastro-entérites étant très fréquentes en France (5 000 consultations en médecine générale/100 000 habitants/an), l’important est de connaître l’algorithme de prise en charge permettant d’aboutir sans retard au diagnostic de maladie de Crohn.
Lors de la première consultation, qui intervient en général lors des 3 premiers jours de diarrhée, il n’est pas licite d’explorer la diarrhée, sauf exceptions (voir chapitre 15, fig. 15.1 : en particulier, si la diarrhée est cliniquement hémorragique ou si un syndrome dysentérique existe, la coloscopie est indiquée d’emblée).
Dans les autres cas, si la diarrhée persiste malgré trois jours de traitement symptomatique, il faut demander une coproculture et un examen parasitologique des selles. La présence d’hématies et/ou de leucocytes nombreux à l’examen direct des selles témoigne de l’existence d’une colite sous-jacente et indique immédiatement les examens endoscopiques. Si les examens de selles sont négatifs et que la diarrhée persiste, ou si la diarrhée persiste malgré le traitement de l’agent pathogène, le recours aux examens endoscopiques est nécessaire.
L’endoscopiste doit décrire les éventuelles lésions endoscopiques iléo-coliques et faire des biopsies, en particulier en zone lésionnelle, pour analyse histologique et microbiologique. Une fois les prélèvements faits, il est licite de traiter la colite présumée infectieuse et/ou inflammatoire par une antibiothérapie empirique d’épreuve. En cas de diarrhée chez un malade ayant séjourné en pays d’endémie amibienne, une cure de métronidazole doit être associée pour couvrir l’hypothèse amibienne, difficile à éliminer avec certitude (voir chapitre 5).
En étant rigoureux dans cette démarche chronologique, le clinicien pourra utiliser sereinement dans un deuxième temps les traitements anti-inflammatoires ou immunosuppresseurs si le diagnostic de MICI se confirme alors que la mise en route de ces traitements pour une colite infectieuse non diagnostiquée peut avoir des conséquences dramatiques.
La confirmation du diagnostic de maladie de Crohn peut venir de l’histologie initiale et/ou de l’évolution. Les signes istologiques ayant la meilleure valeur discriminante en faveur d’une première poussée de maladie de Crohn, sont les anomalies des glandes, la plasmocytose basale et les granulomes. En pratique, lorsque la coloscopie est réalisée tôt (dans les deux premières semaines) dans l’histoire de la diarrhée, ce qui devrait le plus souvent être le cas, les signes évocateurs de MICI manquent plus d’une fois sur deux.
1 . 4 . 2 - Iléite aiguë isolée
Le diagnostic d’une iléite terminale isolée de début aigu fait discuter le diagnostic de première poussée de maladie de Crohn de début aigu et les infections intestinales, en particulier à Yersinia, dont l’atteinte iléale terminale isolée est une forme anatomique de prédilection.
En Europe, les yersinioses sont surtout observées en Europe du Nord. Le mode de contamination principal par Yersinia enterocolitica est l’ingestion de porc insuffisamment cuit dans les 14 jours précédant le début de l’infection. La consommation de lait cru et même pasteurisé (contamination secondaire du lait par le germe qui continue à se multiplier à 4 °C) est une source potentielle de cas sporadiques et de petites épidémies. Les transmissions nosocomiales, de personne à personne, et par transfusion sanguine sont également possibles.
Le diagnostic de yersiniose iléale repose sur la culture de la bactérie à partir des selles et/ou des biopsies muqueuses iléales. Si ces dernières n’ont pu être faites ou sont négatives, il est théoriquement possible de faire secondairement le diagnostic par l’ascension significative (ou par un taux unique très élevé) du taux des anticorps anti-Yersinia O3, O9 et pseudo-tuberculosis. L’intérêt de ce diagnostic rétrospectif est limité par l’existence de faux positifs de cette sérologie (réactivités antigéniques croisées avec d’autres bactéries) et par le fait que, les sérologies étant spécifiques des sérotypes, les 3 sérologies évoquées ci-dessus ne peuvent pas, en cas de négativité, prétendre éliminer définitivement l’hypothèse d’une iléite à Yersinia.
En pratique, il convient au moment de l’iléite aiguë de prescrire un traitement antibiotique par quinolones qui éradiquera l’éventuelle yersiniose en cause. Au décours de ce traitement antibiotique, si l’histologie initiale a été absente ou n’a pas été discriminante entre infection et maladie de Crohn, la persistance de lésions endoscopiques et/ou radiologiques iléales au-delà de 6 mois sera la signature que, si infection par Yersinia il y a eu, elle n’était pas seule en cause
1 . 4 . 3 - Diagnostic différentiel avec la tuberculose
Fréquente au début du vingtième siècle, la tuberculose intestinale est devenue, au milieu du vingtième siècle, rare dans les pays développés, du fait de l’apparition des traitements antituberculeux, et de la diminution progressive des contaminations par Mycobacterium bovis (pasteurisation du lait, contrôles vétérinaires).
La réascension actuelle de l’incidence de la maladie dans les pays développés, en particulier en milieu urbain, est liée notamment à la pandémie par le VIH et à l’émergence de bacilles multirésistants chez les personnes démunies non observantes au traitement. Mycobacterium tuberculosis hominis est presque toujours en cause.
La contamination intestinale tuberculeuse peut se faire par 4 voies :
– hématogène à partir d’une tuberculose pulmonaire active ;
– passage par déglutition de germes dans le tractus digestif à partir d’une tuberculose pulmonaire active ;
– alimentaire (rare, lait non pasteurisé) ;
– atteinte par contiguïté à partir d’un organe de voisinage lésé.
Une fois présentes dans l’intestin, les mycobactéries résident préférentiellement dans la sous-muqueuse. La région iléo-caecale est le site électif des atteintes tuberculeuses intestinales. Les localisations tuberculeuses coliques segmentaires uniques ou multifocales, ne comportant pas une atteinte iléo-caecale associée, représentent 10 à 25 % des cas de tuberculose intestinale. Ce sont elles qui posent parfois les problèmes diagnostiques les plus difficiles. Le tableau clinique de tuberculose colique comporte presque toujours des douleurs abdominales.
L’altération de l’état général est habituelle. La diarrhée, parfois hémorragique, est inconstante surtout dans les formes iléo-coliques droites. La fièvre est fréquente. Une masse de la fosse iliaque droite est palpée jusqu’à une fois sur deux. Le
tableau digestif est associé à une tuberculose pulmonaire active dans 20 % des cas environ, plus rarement à une atteinte péritonéale avec ascite. L’intra-dermoréaction à la tuberculine est positive dans 70 à 80 % des cas. La tuberculose intestinale peut donc représenter un piège diagnostique différentiel redoutable avec la maladie de Crohn quand l’infection ne survient pas sur un terrain à risque avéré (migrant récent, malade dénutri et/ou immunodéprimé, notion de contage récent) et quand elle n’est pas associée à une tuberculose pulmonaire active (cas le plus fréquent). Elle peut mimer macroscopiquement à tous les étages du tube digestif l’ensemble des lésions de maladie de Crohn. Les arguments de certitude du diagnostic de tuberculose intestinale (bacilles acido-alcoolo-résitants) à l’examen direct des biopsies sont presque toujours absents au moment du diagnostic initial. Les cultures de biopsies intestinales sur milieu de Löwenstein sont positives tardivement et au mieux dans 40 % des cas ; la valeur diagnostique de la PCR à partir des biopsies intestinales n’est pas encore établie.
Il faut donc s’aider :
– des caractères histologiques fins des granulomes, présents environ une fois sur deux dans la tuberculose intestinale et contenant du caséum (signe spécifique) une fois sur 2. Les granulomes tuberculeux sont typiquement plus gros que ceux de la maladie de Crohn, siègent essentiellement sous les ulcérations, sont volontiers confluents et sont absents en zone muqueuse non inflammatoire ;
– des arguments indirects de contexte (contage, IDR à la tuberculine, atteinte pulmonaire séquellaire ou active) ;
– de la positivité du Quantiféron, test peu sensible mais très spécifique de la présence de Mycobacterium hominis vivant dans l’organisme (tuberculose latente ou avérée). En cas de doute diagnostique persistant, un traitement d’épreuve anti-tuberculeux est justifié.
2/6