- Pré-requis et Objectifs
-
Cours
-
Contenu
- 1 - Introduction
- 2 - Conduite diagnostique
- 3 - Causes des aménorrhées
- 4 - Conclusion
-
Version PDF

-
Contenu
- Annexes
3 - Causes des aménorrhées
3 . 1 - Aménorrhées avec carence estrogénique secondaire à un déficit gonadotrope d’origine organique ou fonctionnelle (estradiol bas, gonadotrophines « normales » ou basses)
3 . 1 . 1 - Aménorrhées d’origine hypothalamique avec prolactine normale (AH)
Elles peuvent être définies comme l’incapacité de l’hypothalamus à libérer la GnRH avec une pulsatilité de fréquence et d’amplitude compatibles avec la physiologie de la reproduction. Cette définition est confirmée par la réponse à l’administration pulsatile de GnRH exogène qui rétablit la mécanique ovulatoire. Le diagnostic d’AH est souvent évoqué après avoir écarté une dystrophie ovarienne polykystique, ce qui est aisé dans les formes typiques mais plus difficile chez les patientes minces ou maigres.
L’exploration hormonale de ces patientes, très fréquemment en aménorrhée, s’effectue classiquement après test aux progestatifs mais cela n’est pas obligatoire. Ce test est souvent négatif dans les AH, ce qui témoigne tout simplement de la profondeur de la carence estrogénique.
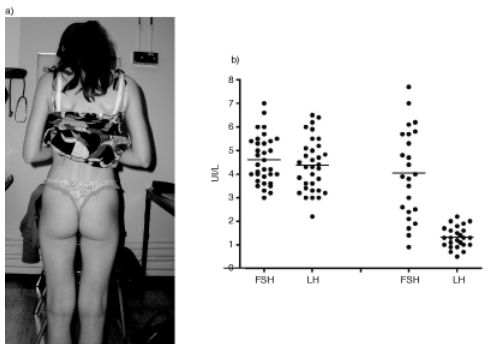
Les concentrations plasmatiques d’estradiol sont basses. Celles de LH et FSH immunoréactives sont parfois « normales », comparables à celles d’une phase folliculaire précoce, mais une baisse préférentielle de la LH, très évocatrice, ou une baisse franche des deux gonadotrophines peut aussi s’observer (figure 19.3).
Fig. 19.3. Aménorrhée hypothalamique fonctionnelle (AHF)
Le test à la GnRH est de valeur diagnostique médiocre : il peut être négatif (absence d’élévation de LH et de FSH après administration intraveineuse de 100 mg de GnRH) ou positif. Il montre parfois une réponse préférentielle de FSH : cela évoque alors une atteinte hypothalamique avec ralentissement de la fréquence de GnRH. Les concentrations des androgènes sont normales ou basses par absence de production ovarienne d’androstènedione non stimulée par la LH.
Une imagerie par résonance magnétique (IRM) ou, à défaut, un scanner de la région hypothalamo-hypophysaire est indispensable, à la recherche d’une éventuelle tumeur ou infiltration.
Pour définir une atteinte hypothalamique, il faudrait théoriquement mettre en évidence une sécrétion altérée de GnRH. Cependant, les concentrations plasmatiques extrêmement faibles et la demi-vie très courte de la GnRH rendent impossible sa mesure dans le sang périphérique. Un témoin indirect de cette sécrétion est obtenu par l’étude de la pulsatilité de LH. Celle-ci nécessite des prélèvements toutes les 10 minutes pendant au moins 8 heures et, au mieux, pendant 24 heures. La fréquence des « pulses » reflète directement l’activité hypothalamique alors que l’amplitude est fonction aussi bien de la quantité de GnRH libérée que du rétrocontrôle au niveau pituitaire de l’estradiol. En fait, l’apport diagnostique de l’étude de la pulsatilité de LH chez ces patientes est limité par la variabilité des profils observés, fonction du type des immunodosages (RIA ou plus récemment IRMA, IFMA ou EIA) alors que ceux-ci seraient souvent perturbés lorsqu’on utilise des dosages biologiques non réalisés en pratique clinique. Une absence totale de pulsatilité, qui témoigne d’une atteinte sévère, s’observe surtout dans les déficits gonadotropes congénitaux. Parfois, il s’agit d’une diminution de la fréquence des « pulses » (c’est le cas des aménorrhées hypothalamiques d’origine nutritionelles) et/ou de l’amplitude. Compte tenu de cette variabilité et des moyens diagnostiques alternatifs, l’intérêt diagnostique des études de pulsatilité est moins important qu’il y a quelques années et la preuve de l’origine hypothalamique de l’anovulation sera souvent apportée par l’absence de pathologie hypothalamo-hypophysaire directement décelable à l’imagerie et surtout par le rétablissement d’une mécanique ovulatoire correcte après administration pulsatile de GnRH exogène.
a. Atteintes organiques ou génétiques de l’hypothalamus
Même si elles sont relativement rares, elles dominent les préoccupations. Chez une patiente présentant une AH, même en l’absence de stigmates cliniques ou biologiques d’atteinte des autres fonctions anté ou post-hypophysaires, un processus tumoral ou infiltratif de la région hypothalamo-hypophysaire doit être recherché par IRM. La radiothérapie encéphalique ou de la base du crâne entraîne également une atteinte hypothalamique.
Dans toutes ces étiologies, l’insuffisance gonadotrope peut être associée à une hyperprolactinémie dite de déconnexion et/ou une insuffisance antéhypophysaire, qui sera recherchée systématiquement. Les tumeurs en cause sont essentiellement les macroadénomes hypophysaires et les crâniopharyngiomes. L’IRM permet d’en faire le diagnostic et d’en évaluer l’extension, en particulier vers les voies optiques et les sinus caverneux, élément majeur des discussions thérapeutiques. L’IRM avec injection de gadolinium permet aussi de faire le diagnostic des processus infiltratifs hypothalamo-hypophysaires, souvent invisibles au scanner, tels que la sarcoïdose, les infundibulo-hypophysites et l’histiocytose.
Les hypogonadismes hypogonadotrophiques congénitaux de la femme se révèlent dans moins de 30 % des cas par une absence complète de développement pubertaire. Un certain développement pubertaire est souvent observé mais l’aménorrhée primaire est quasi constante. S’il s’agit d’un syndrome de Kallmann, lié chez la femme à des mutations des gènes KAL2/FGFR1, PROK2 ou PROKR2 (récepteurs de type 2 de la prokinéticine et de la prokinéticine 2) mais jamais de KAL1, qui touche exclusivement les hommes, et associe à l’hypogonadisme une anosmie, l’aménorrhée résulte d’une anomalie de la migration des neurones à GnRH de la placode olfactive vers le noyau arqué pendant la vie embryonnaire, qui ne sont pas en position anatomique permettant une stimulation des gonadotrophines. A l’IRM les bulbes olfactifs sont absents ou hypoplasiques. Seul un cas de mutation du gène (GnRH1) codant pour la GnRH a été très récemment rapporté chez une femme avec déficit gonadotrope congénital, sans anosmie, dit « idiopathique ». Un certain nombre de ceux-ci résultent aussi d’anomalies génétiques du récepteur GPR54, plus récemment impliquées dans des hypogonadismes hypogonadotrophiques d’origine hypothalamique.
b. Atteintes fonctionnelles hypothalamiques (+++)
Elles sont de loin la cause la plus fréquente d’AH. Elles s’expliquent par les connexions étroites entre le système nerveux central et l’hypothalamus et se traduisent par une perturbation de l’activité pulsatile des neurones à GnRH. De nombreux travaux suggèrent que cette atteinte gonadotrope est liée à la sécrétion anormale de certains neuromédiateurs ayant sur la sécrétion de GnRH un rôle modulateur négatif. Ainsi, les opiacés endogènes ont été mis en cause dans certaines AH régressant après administration d’antagonistes opiacés. Cependant, d’autres données ont remis en question l’implication de ce neuromédiateur. La CRH a aussi été impliquée dans l’atteinte gonadotrope des anorexies mentales et des danseuses et sportives de haut niveau. Ce peptide possède un effet inhibiteur sur la sécrétion de GnRH (peut-être médié par la b – endorphine) mais son rôle dans la physiopathologie de ces AH n’est toujours pas formellement prouvé.
Finalement, la physiopathologie de la grande majorité des AH reste débattue. Bien que souvent classées comme psychogènes, elles semblent presque toujours en rapport avec un apport calorique insuffisant et associées à des perturbations des paramètres reflétant l’état nutritionnel. Des pertes de poids importantes (< 66 % du poids idéal ou BMI < 16) sont associées à un déficit gonadotrope profond. C’est le cas de l’anorexie mentale. Ces patientes ont, à l’échographie, des ovaires de taille normale ou réduite avec quelques follicules antraux.
Un tableau similaire mais beaucoup plus fréquent est observé chez des femmes jeunes apparemment normales (avec un BMI proche de 20, cf. figure 19.3) mais dont les apports nutritionnels, en particulier en lipides, sont insuffisants par rapport à leur dépense énergétique. Ces patientes ont une diminution significative de leur masse grasse qui s’accompagne logiquement d’une baisse de la leptine circulante. Cette baisse pourrait participer à la genèse du déficit gonadotrope fonctionnel. En effet, dans l’espèce humaine les anomalies du gène de la leptine ou de son récepteur sont responsables, outre d’une obésité morbide, d’un déficit gonadotrope congénital. De plus, l’administration de leptine recombinante à un patient ayant une mutation de cette hormone semble rétablir une sécrétion normale des gonadotrophines. Récemment, une preuve très forte de l’implication de la leptine dans la physiopathologie des aménorrhées hypothalamiques fonctionnelles a été apportée par le rétablissement d’une mécanique ovulatoire chez des patientes traitées par la leptine recombinante.
Enfin, des travaux récents suggèrent l’implication d’une baisse du peptide hypothalamique Kiss, induite par la carence nutritionnelle, dans la genèse de la mise au repos de la sécrétion de GnRH chez ces patientes, consécutive à une diminition de la stimulation de ces neurones via le récepteur KISS1R/GPRS4.
c. Traitement des AH
En l'absence de désir de grossesse, si l’atteinte gonadotrope est partielle avec sécrétion persistante d’estradiol mais anovulation, le traitement du déficit en progestérone par progestatifs seuls peut être prescrit. Plus souvent, l’atteinte hypothalamique est profonde et donc un traitement combiné estroprogestatif suffisamment dosé en estrogènes sera indiqué. En effet, on connaît bien maintenant, chez ces femmes jeunes, les conséquences à long terme, sur la minéralisation osseuse, de la carence estrogénique. Le risque ostéoporotique sans parler des conséquences sur la trophicité vaginale et la libido justifient donc toujours l’administration d’estrogènes. En l'absence de pathologie tumorale, si une grossesse est souhaitée, celle-ci est facilement obtenue par l'administration pulsatile sous-cutanée, toutes les 90 minutes, de GnRH, au moyen d'une pompe portable permettant d'obtenir des mono-ovulations suivies de grossesse. La surveillance de ces inductions de l'ovulation par l'administration pulsatile de GnRH est d'une grande simplicité, avec un risque réduit de grossesse multiple si on a pris le soin d’écarter un syndrome des ovaires polykystiques sous-jascent, « masqué » par le déficit fonctionnel en GnRH.
3/6