- Pré-requis et Objectifs
- Cours
- Annexes
- Votre Avis
- Ressources Enseignants
4 - Les tests primaires
4 . 1 - Les tests de génotoxicité
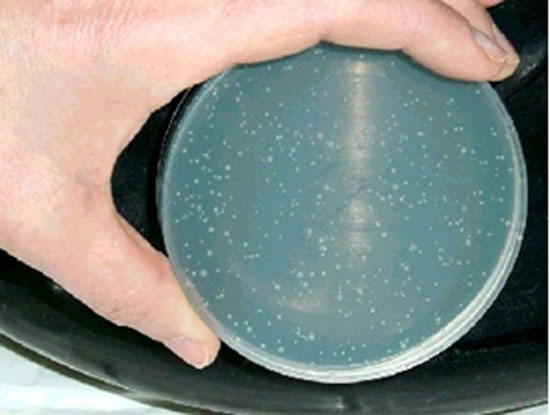
Ils évaluent les effets des dispositifs médicaux et de leurs produits de dégradation sur les mutations géniques, les changements de structure chromosomique ou toute autre modification des gènes et de l’ADN. Le plus connu est le test de Ames. Des mutants de Salmonella Typhimurium, très sensibles aux mutations géniques, ne savent pas synthétiser l’histidine. Si cette souche subit une mutation, celle ci, tôt ou tard devient capable de synthétiser de l’histidine et ainsi peut de se développer sur un milieu sans histidine. On observe alors des formations à la surface dont le nombre est proportionnel à l’effet génotoxique (Figure 1). Parmi les matériaux dentaires, certains adhésifs dentinaires contenant de la glutaraldéhyde sont soupçonnés d’être mutagènes, de même que les pâtes d’obturation canalaire contenant de la formaldéhyde.
Figure 1 : Boîte de culture montrant des colonies de Salmonella Thyphimurium ayant muté après la mise en contact avec un matériau mutagène.
4 . 2 - Test de cytotoxicité
Le matériau est mis en contact avec les cellules cibles puis leur viabilité est évaluée.
Il faut se poser trois questions pour juger de la validité du test de cytotoxicité :
- quelles cellules cibles choisir ?
- quel critère choisir pour évaluer la viabilité cellulaire ?
- le mode de mise en présence des cellules et du matériau est-il judicieux ?
4.2.1. Les cellules cibles
Deux grandes possibilités existent :
- les lignées cellulaires établies qui n'ont rien à voir avec les cellules cibles rencontrées en clinique. Par contre elles sont faciles à cultiver et sont disponibles partout dans le monde. Les plus connues sont les fibroblastes cancéreux de poumon de souris L 929.
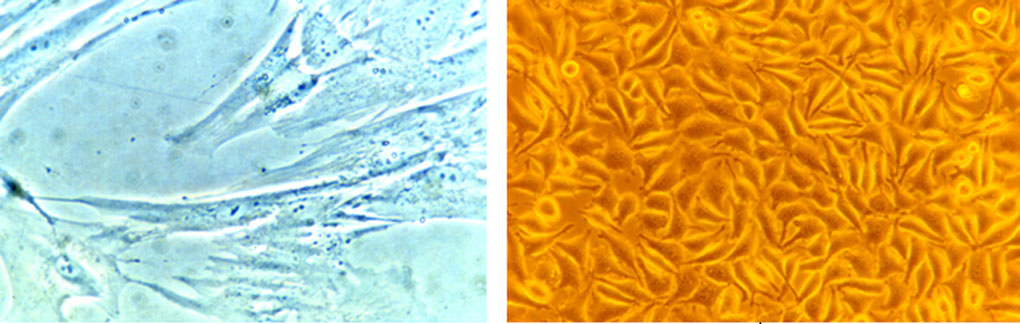
- les cellules de culture primaire qui ont l'avantage d'être plus proches de la cellule cible : fibroblastes pulpaires, gingivaux ou desmodontaux. Ces cellules présentent comme inconvénient d’avoir une durée de vie limitée car elles se dédifférencient après quelques multiplications (Figure 2).
Figures 2 : Exemples de chaque type de cellules pour les tests de cytotoxicité. À gauche une lignée cellulaire établie (L 929) et à droite une culture primaire (fibroblastes pulpaires)
4.2.2. Les critères d’évaluation de la cytotoxicité
Là aussi, deux possibilités existent :
- Test de toxicité basale, valable sur toutes les cellules. Il répond à la question : la cellule est elle vivante ou non (Exemple : bleu trypan), ou mieux : la cellule est vivante mais ses fonctions cellulaires sont elles intactes ? (Exemple : étude de la fonction mitochondriale par le test du MTT, Figure 3).
- Test de toxicité spécifique valable sur les cultures primaires. Il répond à la question : la cellule remplit-elle la fonction pour laquelle elle existe (Exemple : l’odontoblaste continue-t’il à sécréter prédentine malgré la présence du biomatériau ?).
Figure 3 : Fibroblastes pulpaires après un test au MTT.
4.2.3. Les différents tests
- Les tests de contact direct
Le matériau est mis en place à l’aide d’une colle biologique au fond d’une boite de culture cellulaire. Des cellules en suspension dans du milieu de culture sont alors ensemencées dans la boite. Les cellules cibles adhérent alors au fond de la boite et après un temps donné, la distance qui sépare les cellules du matériau est mesurée, les cellules venant au contact du matériau s’il est non toxique alors qu’elles en restent éloignées s’il libère des produits cytotoxiques (Figure 4).
Figure 4 : Fibroblastes pulpaires au contact d’un biomatériau lors d’un test de contact direct.
- Surimposition de gélose (agarose)
Les cellules sont ensemencées au fond d’une boîte de culture. Le milieu de culture est remplacé par de l’agarose. Après gélification de l’agarose sur les cellules, le matériau à tester est disposé à la surface de la gélose durcie et le tout est remis à l’étuve pendant 24 h. Les produits cytotoxiques libérés par le matériau diffusent à travers l’agarose pour atteindre les cellules cibles (Figure 5).
Figure 5 : Zones d’inhibitions décolorées lors d’un test de surimposition d’agarose évaluant la cytotoxicité de certains ciments de scellement canalaires
- Interposition de dentine naturelle
Une tranche de dentine coupée avec une scie diamantée est interposée entre les cellules cibles et le matériau à tester. Le matériau est mis en place sur la dentine en suivant les recommandations du fabricant.
4/7